时间:2025-06-26 02:49:35
1、选择题 如图,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象;当打开B阀后,C处红布条逐渐褪色。则D瓶中装的是 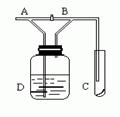 ?
?
A.浓盐酸
B.NaOH溶液
C.H2O
D.饱和NaCl溶液
2、选择题 下列物质在空气中久置变质,在变质过程中既有氧化还原反应发生又有非氧化还原反应发生的是(?)
A.NaOH
B.漂白粉
C.氯水
D.生石灰
3、选择题 自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是( )
A.NaNO3
B.FeCl2
C.Na2SO4
D.AlCl3
4、选择题 下列关于F、Cl、Br、I的比较中,不正确的是
A.它们的原子核外电子层数随原子序数的增加而增多
B.被其它卤素单质从卤化物中置换出来的可能性随原子序数的增加而增大
C.它们的氢化物的稳定性随原子序数的增加而增强
D.它们的单质颜色随原子序数的增加而加深
5、计算题 (8分)将15.68L(标准状况)的氯气通入70℃.500mL氢氧化钠溶液中,发生了两个自身氧化还原反应,其氧化产物为次氯酸钠和氯酸钠。若取此溶液25mL,稀释到250mL,再取稀释后的溶液25mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾。用浓度为0.20mol/L硫代硫酸钠(Na2S2O3)测定析出的碘:I2+2Na2S2O3=2NaI+Na2S4O6,需用硫代硫酸钠溶液5.0mL。将上述测定后的溶液再用盐酸调至强酸性,此时氯酸钠亦能氧化碘化钾,析出的碘再用上述硫代硫酸钠测定,又用了30.0mL。
(1)计算反应后溶液中次氯酸钠和氯酸钠的物质的量之比。
(2)用一个总化学方程式表示题中氯气通入70℃氢氧化钠溶液中所发生的化学反应。
(3)假设题中氢氧化钠溶液的体积在通入氯气前后的变化可忽略不计,请计算通入氯气后各生成物的物质的量浓度。