时间:2025-06-26 02:43:05
1、填空题 (10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- 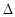 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) 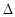 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) 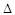 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 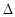 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
(3)已知:2NO2(g)  N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变);
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
A.减小NO2的浓度
B.降低温度
C.增加NO2的物质的量
D.升高温度
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
2、选择题 下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
3、选择题 反应H2(g)+I2(g)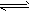 2HI(g)的平衡常数K1;反应HI(g)
2HI(g)的平衡常数K1;反应HI(g)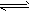 1/2H2(g)+1/2I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
1/2H2(g)+1/2I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
[? ]
A.K1=2K2
B.K1=K22
C.K1=1 /K22
D.K1=1/2K2
4、填空题 在一定体积密闭容器中,进行如下反应: CO2(g
CO2(g ) + H2(g)
) + H2(g) 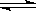 CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
5、选择题 可逆反应H2(g)+I2(g)  2HI(g)?
2HI(g)? H<0, 达到平衡后,当改变外界条件如物质浓度、体系压强等而发生下列项目的变化时,能做为平衡一定发生了移动的标志的是
H<0, 达到平衡后,当改变外界条件如物质浓度、体系压强等而发生下列项目的变化时,能做为平衡一定发生了移动的标志的是
[? ]
A.气体的密度变小了?
B.反应物和生成物浓度均变为原来的2倍?
C.气体的颜色变深了?
D.体系的温度发生了变化