时间:2025-06-26 02:43:05
1、填空题 某校化学实验小组同学进行有关NO2气体的系列实验。
(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
参考答案:(11分)
(1)红棕色( 1分)无色( 1分)
Cu + 4HNO3 (浓)===Cu(NO3)2 + 2NO2↑+ 2H2O ( 1分)
3NO2 + H2O===2HNO3 + NO ( 1分)
(2)变浅(1分), 2NO2 N2O4 ΔH<0 ,温度降低,平衡向正反应方向移动,c(NO2)浓度降低(2分)
N2O4 ΔH<0 ,温度降低,平衡向正反应方向移动,c(NO2)浓度降低(2分)
(3)① a="0.28" (1分), 1.8 (1分), ②减小(1分) ③ A (1分)
本题解析:(1)烧瓶内发生的反应为:Cu + 4HNO3 (浓)===Cu(NO3)2 + 2NO2↑+ 2H2O,得到红棕色的气体NO2;
用排水法收集时发生反应:3NO2 + H2O===2HNO3 + NO,故在试管中收集到的气体为无色的NO
(2)由于存在可逆反应:2NO2 N2O4 ΔH<0,故将烧瓶浸入冰水中,相当于降温,平衡正向移动,c(NO2)浓度降低,混合气体的颜色变浅;
N2O4 ΔH<0,故将烧瓶浸入冰水中,相当于降温,平衡正向移动,c(NO2)浓度降低,混合气体的颜色变浅;
(3)反应:N2O4 2NO2
2NO2
初n: 0.4 0
20s: 0.28 0.24
80s: 0.1 0.6
①可见a=0.28,在80s时反应达到平衡,K=
②平衡后,向该容器中再充入N2O4气体,相当于加压,平衡N2O4 2NO2左移,则N2O4的转化率减小
2NO2左移,则N2O4的转化率减小
③A.增大N2O4的起始浓度,相当于加压,平衡左移,c(NO2)/c(N2O4)值变小,符合题意
B.升高温度,平衡正向移动,排除
C.使用高效催化剂,不会影响平衡移动,排除
D.向混合气体中通入稀有气体,各物质浓度不变,平衡不移动,排除
选A
本题难度:一般
2、选择题 CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡: [Cu(H2O)4]2++4Cl- ?[CuCl4]2-+4H2O
?[CuCl4]2-+4H2O
蓝色 ? 绿色
欲使溶液由绿色变为蓝色,可采用的方法是?
[? ]
A.加NaCl溶液?
B.加水
C.加AgNO3溶液?
D.加NaOH溶液
参考答案:BC
本题解析:
本题难度:一般
3、选择题 在一定温度下,可逆反应N2(g)+3H2(g)?2NH3(g)达到平衡状态的标志是( )
A.氨气生成的速率与氮气分解的速率相等?
B.氮气、氢气、氨气的浓度不再变化?
C.单位时间内,生成n?mol?氮气,同时生成3n?mol?氢气?
D.氮气、氢气、氨气分子数之比为1:3:2?
参考答案:A.当氨气的生成速率与氮气的生成速率之比为2:1时,该反应达到平衡状态,当氨气的生成的速率与氮气分解的速率相等时该反应未达到平衡状态,故A错误;
B.当反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,所以当氮气和氢气、氨气浓度不再变化时,该反应达到平衡状态,故B正确;
C.无论该反应是否达到平衡状态,单位时间内,生成n?mol?氮气,就同时生成3n?mol?氢气,所以该反应不一定达到平衡状态,故C错误;
D.当氮气、氢气、氨气分子数之比为1:3:2时,该反应可能达到平衡状态,也可能没有达到平衡状态,与反应物初始浓度、转化率有关,故D错误;
故选B.
本题解析:
本题难度:简单
4、简答题 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为______.
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量______,若升高温度,则该反应的平衡常数______(均填“增大”、“减小”或“不变”).
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变),在______时间段CO的转化率最大.
t1:增大NO的浓度t2:降低温度
(4)通过计算判断该条件下反应能否自发进行?(要求写出计算过程)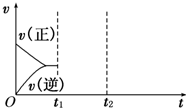
参考答案:(1)提高该反应的速率,可以增大压强、升高温度、增大浓度或使用催化剂等,同时使NO的转化率增大,应使平衡向正反应方向移动,
A.加催化剂同时升高温度,反应速率增大,正反应为放热反应,平衡向逆反应方向移动,NO的转化率降低,故A错误;
B.加催化剂同时增大压强,反应速率增大,正反应为气体体积减小的反应,平衡向正反应方向移动,NO的转化增大,故B正确;
C.升高温度同时充入N2,反应速率增大,平衡向逆反应方向移动,NO的转化率减小,故C错误;
D.该反应正反应为体积减小的放热反应,降低温度同时增大压强,平衡向正反应方向移动,NO的转化率增大,但反应速率不一定增大,故D错误;
故答案为:B;
(2)该反应正反应方向为物质的量减小的反应,达到平衡时若增大压强,混合气体总的质量不变,总的物质的量减小,则混合气体的平均相对分子质量增大;
正反应为放热反应,若升高温度,平衡向逆反应方向移动,该反应的平衡常数减小,
故答案为:增大;减小;
(3)t1:增大NO的浓度,瞬间正反应速率增大、逆反应速率不变,平衡向正反应方向移动,t2:降低温度,瞬间正、逆反应速率都低于增大NO的浓度到达平衡时的速率,正反应为放热反应,平衡向正反应方向移动,逆反应速率降低更大,图象为: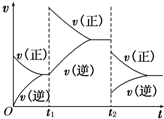 ,在t2以后达平衡时,CO的转化率最大,
,在t2以后达平衡时,CO的转化率最大,
故答案为: ;t2以后达平衡;
;t2以后达平衡;
(4)△G=△H-T?△S=-113kJ/mol+298K×145×10-3kJ/(mol?K)=-69.79kJ/mol<0,故反应能自发进行,
答:能,△G=△H-T?△S=-113kJ/mol+298K×145×10-3kJ/(mol?K)=-69.79kJ/mol<0,故反应能自发进行.
本题解析:
本题难度:一般
5、选择题 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
参考答案:B
本题解析:
本题难度:简单