ʱ��:2025-06-26 02:32:27
1��ѡ���� ԭ��صķ�Ӧԭ����
[? ]
A���������
B��������ԭ��Ӧ
C�����ϼ۱仯
D������ת��Ϊ��ѧ��
�ο��𰸣�B
���������
�����Ѷȣ���
2��ѡ���� ijԭ����ܷ�Ӧ���ӷ���ʽΪ2Fe3++Fe�T3Fe2+����ʵ�ָ÷�Ӧ��ԭ����ǣ�������
A������Ϊͭ������Ϊ�����������ҺΪFeCl3��Һ
B������Ϊͭ������Ϊ�����������ҺΪFe��NO3��2��Һ
C������Ϊ��������Ϊп���������ҺΪFe2��SO4��3
D������Ϊ��������Ϊ�����������ҺΪCuSO4
�ο��𰸣�A�����Ļ����Դ���ͭ������������ͭ���������������ҺΪ�Ȼ�������������ʵ�ָ÷�Ӧ��ԭ��أ���A��ȷ��
B���������Է���������ԭ��Ӧ�����Բ���ʵ�ָ÷�Ӧ��ԭ��أ���B����
C��п�Ļ����Դ�������п�������������������������ҺΪ�������������Dz���ʵ�ָ÷�Ӧ��ԭ��أ���C����
D�����Ļ����Դ����������������������������������ҺΪ����ͭ�������Dz���ʵ�ָ÷�Ӧ��ԭ��أ���D����
��ѡA��
���������
�����Ѷȣ���
3�������� ��ͭƬ��пƬ��200 mL������ɵ�ԭ����У���пƬֻ�����绯ѧ��ʴ������ͭƬ�Ϲ��ų�0.15 mol����ʱ��H2SO4ǡ��ȫ�����ꡣ������Щ��������п���ٿˣ�������������ʵ���Ũ���Ƕ��٣�
�ο��𰸣�9.75 g? 0.75 mol��L-1
����������˷�Ӧ���ܷ�Ӧ��
Zn? +? 2H+? ="===?" Zn2+? +? H2��
65 g? 2 mol? 1 mol
x? y? 0.15 mol
x=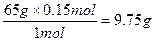 ? y=
? y= ?mol
?mol
H2SO4�����ʵ���Ϊ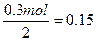 ?mol
?mol
c(H2SO4)= ?mol��L-1
?mol��L-1
�����Ѷȣ���
4��ѡ���� �����ʺϵ�����������Ӧ2Fe3++2I-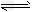 I2+2Fe2+��Ƴ���ͼ��ʾ��ԭ��ء������жϲ���ȷ����?
I2+2Fe2+��Ƴ���ͼ��ʾ��ԭ��ء������жϲ���ȷ����?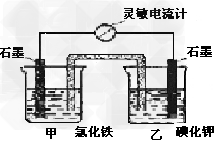
[? ]
A.?��Ӧ������ʼʱ������ʯī�缫�Ϸ���������Ӧ ?
B.?�����ƶ���Ϊ��ʱ����Ӧ�ﵽ��ѧƽ��״̬ ?
C.?�����ƶ���Ϊ��������ձ����ӵ���ˮϡ�ͣ�������ָ�벻����ƫ��
D.?�����ƶ���Ϊ����ڼ���������FeCl2���壬����ʯī�缫Ϊ����
�ο��𰸣�C
���������
�����Ѷȣ�һ��
5������� ����ͭ��пƬ��200mLϡ�������ԭ��أ�����ѧ��ת��Ϊ���ܣ�������ȫ����������ʱ��ͭƬ�Ϲ�����3.36L����״�������壮�Լ��㣺
��1��������ͨ���ĵ��ӵ����ʵ���Ϊ______��
��2��ԭϡ������Һ��H+�����ʵ���Ũ��Ϊ______��
�ο��𰸣�ԭ��ص������缫�����ĵ缫��Ӧ�ǣ�������2H++2e-��H2����������Zn��Zn2++2e-��
ͭƬ����������3.36L����״������������0.15mol������������ת�Ƶĵ���Ϊ0.3mol��
��Һ�е���������0.3mol������ԭϡ������Һ��H+�����ʵ���Ũ��=0.3mol0.2L=0.15mol/L���ʴ�Ϊ��1.5mol/L��
���������
�����Ѷȣ�һ��