时间:2025-06-26 02:30:48
1、填空题 (10分)铁元素的化合价有+2、+3两种,磁铁矿的主要成分是Fe3O4,能与盐酸反应生成两种盐。
(1)请用铁的+2价、+3价的氧化物形式表示Fe3O4可写成___________________
(2)写出Fe3O4与盐酸反应的离子方程式_________________。
(3)设计实验验证反应后溶液中含有Fe3+所用的试剂和反应的化学方程式__________、______________。
(4)设计实验验证反应后溶液中不含Fe3+而可能含有Fe2+。进行实验操作的顺序有:①加入足量氯水,②加入足量高锰酸钾溶液,③加入少量硫氰化钾溶液,选择所需要的试剂及先后的顺序是______________(注意先后顺序)。
(5)将反应后的溶液中Fe3+全部转化为Fe2+,最适宜的物质是选用___________。
(6)将反应后的溶液中Fe2+全部转化为Fe3+,选用的绿色试剂是H2O2 ,H2O2在酸性的条件下将Fe2+氧化为Fe3+,写出反应的离子方程式___________________。
参考答案:(10分) (1)FeO·Fe2O3?(1分)? (2)Fe3O4+8H+=2Fe3++Fe2++4H2O?(2分)
(3)KSCN (1分)? FeCl3+3KSCN=Fe(SCN)3+3KCl (2分)
(4) ③①?(1分)? (5)铁 (1分)
(6)2Fe2++H2O2+2H+=2Fe3++2H2O?(2分)
本题解析:(1)设四氧化三铁中+2价、+3价的铁分别是a和b,则a+b=3、2a+3b=4×2,解得x=1、b=2,所以铁的+2价、+3价的氧化物形式表示Fe3O4可写成FeO·Fe2O3。
(2)根据(1)可知,Fe3O4与盐酸反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O。
(3)铁离子能和KSCN溶液反应使溶液显红色,所以验证反应后溶液中含有铁离子的试剂使KSCN溶液,反应的化学方程式是FeCl3+3KSCN=Fe(SCN)3+3KCl。
(4)验证反应后溶液中不含Fe3+而可能含有Fe2+,则首先应该加入KSCN溶液,如果不变色,再加入氧化剂。由于酸性高锰酸钾溶液是紫红色,所以选择的氧化剂最好是新制的氯水,答案是③①。
(5)铁离子能把铁氧化生成亚铁离子,而铁离子也是被还原生成亚铁离子,所以将反应后的溶液中Fe3+全部转化为Fe2+,最适宜的物质是选用铁。
(6)双氧水的还原产物是水,则反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。
点评:该题是中等难度的试题,试题综合性强,考查的知识点比较多。该题再注重对性质基础知识考查和巩固的图示,主要是侧重培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力和创新思维能力。
本题难度:一般
2、填空题 由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下: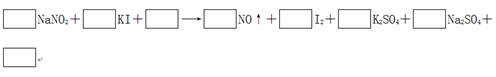 ?
?
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。
参考答案:(1)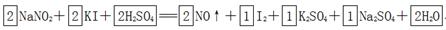
(2)2.408×1023(或0. 4NA)? (3)反应生成了NO,该物质会造成大气污染;还原性;强
本题解析:(1)根据方程式可知,碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,做还原剂。亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,做氧化剂。则根据电子守恒可知氧化剂和和还原剂的物质的量之比时1:1。根据原子守恒可知,反应物中还有硫酸生成,生成物还有水生成,则反应的化学方程式是2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O。
(2)50.8g单质碘的物质的量是50.8g÷254g/mol=0.2mol,所以转移电子的物质的量是0.2mol×2=0.4mol,个数是0.4NA。
(3)由于反应生成了NO,该物质会造成大气污染,所以该方法不是最佳方法。从环保角度来讲,要处理NaNO2,所用物质的还原性应该比KI更强。
点评:该题是基础性试题的考查,主要是考查学生对氧化还原反应的判断、配平以及计算的了解掌握情况。该题的关键是准确标出有关元素的化合价变化情况,然后结合题意和电子得失守恒灵活运用即可,难度不大。
本题难度:一般
3、选择题 火法炼铜的原理为:Cu2S + O2?="==" 2Cu + SO2,下列说法中,正确的是
A.Cu2S 只做还原剂
B.O2发生氧化反应
C.S元素被氧化
D.当0.8mol O2参加反应时,共转移了3.2mol电子
参考答案:C
本题解析:根据方程式可知,S的化合价从-2价升高到+4价,铜的化合价从+1价降低到0价,所以Cu2S既是氧化剂,也是还原剂。氧气是氧化剂,所以AB不正确,C正确。D不正确,转移电子应该是0.8mol×64.8mol,D不正确,答案选C。
本题难度:一般
4、选择题 下列离子方程式表示的是氧化还原反应的是
[? ]
A.HCO3-+OH-==CO32-+H2O
B.2Fe3++Fe=3Fe2+
C.H3PO4+3OH-=PO43-+3H2O
D.Zn+2H+=Zn2++H2↑
参考答案:BD
本题解析:
试题分析:
氧化还原反应的判断方法是:化合价变化的反应是氧化还原反应。
选项A,反应前后元素的化合价不变,不是氧化还原反应;
选项B,铁元素的化合价变化,是氧化还原反应;
选项C,反应前后化合价不变,不是氧化还原反应;
选项D,Zn和H元素化合价变化,是氧化还原反应。
故选:BD
本题难度:简单
5、选择题 下列叙述正确的是(?)
A. 具有还原性,故可作漂白剂
具有还原性,故可作漂白剂
B. 的金属活性比
的金属活性比 强,故可用
强,故可用 与
与 溶液反应制
溶液反应制
C.浓硝酸中的 见光分解,故有时在实验室看到的浓硝酸呈黄色
见光分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在 中燃烧生成
中燃烧生成 ,故在与其他非金属反应的产物中的Fe也显+3价
,故在与其他非金属反应的产物中的Fe也显+3价
参考答案:C
本题解析:A错, 具有漂白性,故可作漂白剂;B错
具有漂白性,故可作漂白剂;B错 与
与 溶液反应先生成氢氧化钠和氢气,生成的氢氧化钠再与氯化镁反应生成氢氧化镁沉淀和氯化钠,无镁生成;C正确;D错,如硫与铁反应生成硫化亚铁;
溶液反应先生成氢氧化钠和氢气,生成的氢氧化钠再与氯化镁反应生成氢氧化镁沉淀和氯化钠,无镁生成;C正确;D错,如硫与铁反应生成硫化亚铁;
本题难度:简单