时间:2025-06-26 02:26:54
1、选择题 将 Al、CuO、Fe2O3组成的混合物共10.0 g放入50 mL稀硫酸中,混合物完全溶解,当再加入50 mL 2.00 mol/L的NaOH溶液时,得到沉淀最多。上述硫酸溶液的浓度为
A.0.500 mol/L
B.1. 00 mol/L
C.2. 00 mol/L
D.3. 00 mol/L
参考答案:B
本题解析:得到沉淀最大量的时候说明Al3+、Cu2+、Fe3+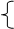 离子全部沉淀,溶液中的阳离子只有Na+,阴离子只有SO42-,根据Na+守恒,可知n(SO42-)=0.05mol,所以硫酸的浓度为1mol/L。答案选B。
离子全部沉淀,溶液中的阳离子只有Na+,阴离子只有SO42-,根据Na+守恒,可知n(SO42-)=0.05mol,所以硫酸的浓度为1mol/L。答案选B。
点评:本题要用守恒法来解。守恒法在化学计算中非常重要,使得很多计算比较苦难的习题变得简单了。
本题难度:简单
2、填空题 (4分)已知CO和CO2的混合气体14.4g,在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为?g,CO2的物质的量为?mol。
参考答案:(4分)? 5.6? 0.2
本题解析:设混合气中CO和CO2的物质的量分别是x和y,则28x+44y=14.4g,x+y=8.96L÷22.4L/mol=0.4mol,解得x=y=0.2mol,所以CO的质量是0.2mol×28g/mol=5.6g。
本题难度:一般
3、选择题 下列溶液中的氯离子浓度与50 mL 1 mol·L-1 的AlCl3溶液中氯离子浓度相等的是(?)
A.150 mL 1 mol·L-1的NaCl
B.75 mL 1 mol·L-1的FeCl2
C.150 mL 3 mol·L-1的KCl
D.75 mL 2 mol·L-1的CaCl2
参考答案:C
本题解析:根据物质的化学式可知,氯化铝溶液中氯离子浓度是3mol/L的。而在选项中氯离子浓度分别是(mol/L)1、2、3、4,所以答案选C。
本题难度:一般
4、选择题 下列各组物质中,所含分子数一定相同的是
A.10gH2和10gO2
B.5.6LN2和5.6L CO2
C.14g CO和0.5molBr2
D.标准状况下2.24LH2O和0.1molN2
参考答案:C
本题解析:H2和O2的摩尔质量不相等,所以质量相同的时候,物质的量不相等,分子数就不相等,A错;没有说明是否在相同条件下,5.6LN2和5.6L CO2的物质的量无法比较,B错;14g CO的物质的量为:14g÷28g/mol=0.5mol,与0.5molBr2 的物质的量相等,则分子数相等,C对;标准状况下H2O是液体,知道体积无法计算物质的量,D错,选C。
考点:有关物质的量的计算、气体摩尔体积的使用条件、阿伏伽德罗常数的应用。
本题难度:一般
5、选择题 用98%的浓H2SO4(密度为1.84g/mL)配制1mol/L?H2SO4溶液100mL,配制过程中可能用到下列仪器:
①100mL量筒?②10mL量筒?③50mL烧杯?④托盘天平?⑤100mL容量瓶?⑥胶头滴管?⑦玻璃棒
按使用的先后顺序排列正确的是( )
A.②⑥③⑦⑤
B.④③⑤⑦⑥
C.①③⑦⑤⑥
D.②⑤⑦⑥
参考答案:A
本题解析:
本题难度:简单