时间:2025-06-26 02:22:50
1、选择题 下列离子组能够大量共存的是
A.无色溶液中:Cu2+、K+、NO3-、Cl-
B.使pH试纸显红色的溶液中:Fe2+、K+、NO3-、Cl-
C.含MnO4-的溶液中:Fe3+、SO42-、NO3-、Mg2+
D.与铝作用生成氢气的溶液中:Mg2+、NO3-、K+、Cl-
参考答案:C
本题解析:略
本题难度:一般
2、选择题 一定量混合气体在密闭容器中发生如下反应:xA(气)+yB(气)? zC(气),达平衡后测得A气体的浓度为0.50 mol/L。恒温下将容器扩大1倍,反应重新平衡,测得A浓度为0.30mol/L。下列叙述中正确的是:?
A.x+y<z
B.平衡向右移动
C.B的转化率提高
D.C的体积百分含量降低
参考答案:D
本题解析:恒温下将容器扩大1倍,如果不考虑平衡移动,A浓度应为0.25mol/L,而测得A浓度为0.30mol/L,说明平衡逆向移动,C的体积百分含量降低,故D正确。
本题难度:一般
3、选择题 浓度为0.50 mol/L的某金属阳离子Mn+的溶液10.00ml ,与0.40 mol/L的NaOH溶液12.50 ml恰好完全反应生成沉淀,则n等于
A.1
B.2
C.3
D.4
参考答案:A
本题解析:0.50 mol/L的某金属阳离子Mn+的溶液10.00ml的物质的量为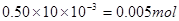 ,0.40 mol/L的NaOH溶液12.50 ml的物质的量为
,0.40 mol/L的NaOH溶液12.50 ml的物质的量为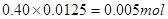 ,所以Mn+的n等于1;
,所以Mn+的n等于1;
本题难度:简单
4、填空题 (16分)Ⅰ.某无色溶液X,由K+、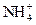 、Ba2+、Al3+、Fe3+、
、Ba2+、Al3+、Fe3+、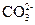 、
、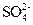 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验: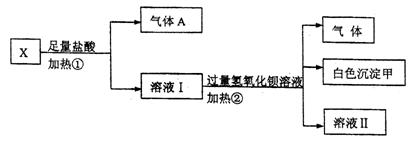
(1)白色沉淀甲是 。
(2)试写出实验过程中生成气体A、B的离子方程式 、 。
(3)通过上述实验,可确定X溶液中一定存在的离子是 ,要确定可能存在的离子,需补加的实验是 。
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示: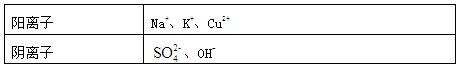
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。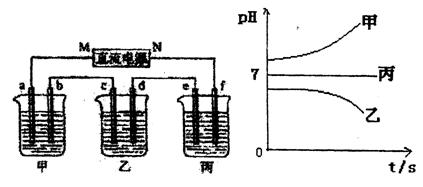
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电 解时间t的关系图如上。据此回答下列问题:
解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 。
(2)计算电极e上生成的气体在标准状况下的体积 ;
(3)写出乙烧杯的电解池反应 。
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。
参考答案:(16分)
Ⅰ(1)BaSO4(1分)
(2)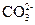 +2H+=CO2↑+H2O(1分)
+2H+=CO2↑+H2O(1分) 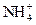 +OH-
+OH-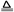 NH3↑+H2O(1分)
NH3↑+H2O(1分)
(3)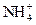 、
、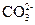 、
、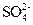 (2分) 做焰色反应,透过蓝色钴玻璃片若火焰呈紫色则含K+,否则不含K+。(2分)
(2分) 做焰色反应,透过蓝色钴玻璃片若火焰呈紫色则含K+,否则不含K+。(2分)
Ⅱ.(1)负(1分);4OH--4e-=2H2O+O2↑ (1分)
(2)5.6L(1分)
(3)2CuSO4+2H2O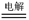 2Cu+O2↑+2H2SO4(2分)
2Cu+O2↑+2H2SO4(2分)
(4)能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应(2 分)
分)
(5)向丙烧杯中加4.5g水(2分)
本题解析:略
本题难度:困难
5、选择题 水溶液中能大量共存的一组离子是
A.Na+、Cu2+、Cl-、SO42-
B.Fe3+、H+、SO32-、ClO-
C.Pb2+、NH4+、Cl-、SO42-
D.K+、Fe3+、NO3-、SCN-
参考答案:A
本题解析:A.Na+、Cu2+、Cl-、SO42-在水溶液中不会发生任何反应,可以大量共存,正确;B. H+、SO32-、ClO-会发生氧化还原反应而不能大量共存,错误;C.Pb2+、SO42-会发生离子反应产生PbSO4沉淀而不能大量共存,错误;D. Fe3+、SCN-会形成络合物而不能大量共存,错误。
考点:考查离子大量共存的知识。
本题难度:一般