时间:2025-06-26 02:22:50
1、选择题 某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。
(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。
根据上述实验情况,以下说法错误的是( )。
A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32-
B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3-
D.向该混合溶液中滴加酚酞试液后呈红色
参考答案:D
本题解析:第一份加入足量盐酸,产生气体在空气中变为红色,说明溶液含有NO3?和还原性离子Fe2+或I?,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生,说明含有SO42?;第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出,说明不含Al3+,含有NH4+、Fe2+或Fe3+,各离子的浓度均约为0.1mol/L,可知该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3-,一定不含有Fe3+、AlO2-、Al3+、CO32-,故A、C正确;通过继续进行焰色反应可检验是否含有Na+,若含有Na+,则含有I?,若不含Na+,则不含有I?,故B项正确;D、因为Fe2+、I?水解,溶液呈酸性,滴加酚酞试液后为无色,错误。
考点:本题考查离子的推断。
本题难度:困难
2、选择题 H++OH-=H2O表示下列哪组离子反应
A.Cu(OH)2与H2SO4
B.Ba(OH)2与H2SO4
C.Fe(OH)3与HCl
D.KHSO4与KOH
参考答案:D
本题解析:略
本题难度:简单
3、填空题 某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。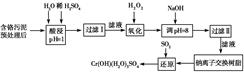
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 11.1 | 8 | 9(>9溶液) |
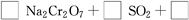
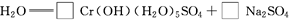 ;
;参考答案:(1)①升高温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间(只要答出任意一点即可,其他合理答案也可) (2)Fe3+和Al3+
(3)Mg2+、Ca2+
(4)1 3 11 2 1 1.5 mol
本题解析:(1)提高酸浸浸取率的方法有很多,如加热、搅拌、延长浸取时间等。
(2)当pH=8时,Fe3+和Al3+都已经完全沉淀。
(4)先用化合价升降法配得Na2Cr2O7、SO2的化学计量数分别为1、3,然后再配平整个方程式。根据化学方程式,可知生成1 molCr(OH)(H2O)5SO4消耗SO2的物质的量为1.5 mol。
本题难度:一般
4、选择题 常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是( )
A.使酚酞变红色的溶液:Na+、Ba2+、I
参考答案:
本题解析:
本题难度:一般
5、填空题 (10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1;由②可知存在的离子为 ,浓度是 mol·L-1;由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
参考答案:(1)NH4+ 0.2;Al3+ 0.2;SO42- 0.5
(2)Fe3+、Mg2+、Ba2+、CO32-
(3)已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量,依据电荷守恒,一定有K+存在。
本题解析:(1)与氢氧化钠溶液反应产生气体,说明原溶液中含有铵根离子,所以由①可知存在的离子为NH4+,100mL溶液中含有0.02mol NH4+,则铵根离子的浓度是0.2 mol·L-1;因为加入过量氢氧化钠溶液无沉淀生成,说明原溶液中不存在Fe3+、Mg2+,通入过量二氧化碳后有沉淀生成,说明原溶液中存在Al3+,1.02g的固体是氧化铝,物质的量是0.01mol,则Al3+的浓度是0.01mol×2/0.1L=0.2mol/L;由③可知原溶液中存在SO42-,11.65g固体是硫酸钡的质量,其物质的量是0.05mol,所以SO42-的浓度是0.05mol/0.1L=0.5mol/L;
(2)根据以上分析,硫酸根离子的存在,则一定不存在Ba2+,Al3+离子的存在,则一定不存在CO32-,因为加入过量氢氧化钠溶液无沉淀生成,说明原溶液中不存在Fe3+、Mg2+,所以原溶液中肯定不存在的是Fe3+、Mg2+、Ba2+、CO32-
(3)根据溶液呈电中性的原理,此时溶液中的负电荷浓度是0.5mol/L×2=1mol/L,正电荷的浓度是0.2+0.2×3=0.8mol/L<1mol/L,所以一定含有K+。
考点:考查溶液中离子的判断与计算
本题难度:一般