时间:2025-06-26 02:17:06
1、填空题 I. 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g) CH3OH(g).
CH3OH(g).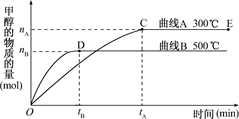
根据题意和所给图象完成下列各题:反应达到平衡时,平衡常数表达式K=?,
(2)升高温度,K值??(填“增大”“减小”或“不变”).
II. 可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: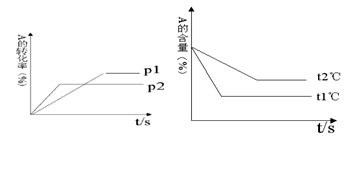
(1)压强 P1比P2?(填大或小);(2)(a +b)比(c +d)?(填大或小);
(3)温度t1℃比t2℃?(填高或低);(4)正反应为?反应。
参考答案:I(1)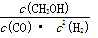 (2)减小?II(1)小(2)小?(3)高(4)放热
(2)减小?II(1)小(2)小?(3)高(4)放热
本题解析:I.(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知平衡常数表达式K=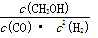 。
。
(2)根据图像可知,温度越高,甲醇的物质的量越少,这说明升高温度平衡向逆反应方向移动,所以升高温度平衡常数减小。
II(1)压强为P2时首先达到平衡状态,所以压强 P1比P2小。
(2)压强高,反应物的转化率低,这说明增大压强平衡向逆反应方向移动,所以正方应是体积增大的可逆反应,则(a +b)比(c +d)小。
(3)温度为t1时首先达到平衡状态,则温度t1℃比t2℃高。
(4)温度高反应物的转化率低,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练。该题的关键是明确反应速率和平衡常数的含义以及影响因素,然后依据图像和方程式灵活运用勒夏特列原理判断即可。有利于培养学生的逻辑推理能力,提高学生分析、归纳、总结问题的能力。
本题难度:一般
2、填空题 已知A(g)+B(g)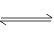 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
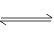 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。 参考答案:(1)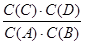 <(2)0.022 0.09 80% 80% (各2分)
<(2)0.022 0.09 80% 80% (各2分)
(3)C (4)2.5
本题解析:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数表达式k=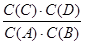 ,由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
,由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为0.20/5=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,设平衡时A的浓度变化量为x,则:
A(g)+B(g) ? C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故x×x/[(0.04-x)×(0.16-x)]=1,解得x=0.032
所以平衡时A的转化率为0.032/0.04×100%=80%,
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
(3)该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,所以本题的答案选择c。
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应
C(g)+D(g)?A(g)+B(g)的平衡常数的值为1/0.4=2.5
考点:化学平衡计算、平衡常数计算、化学反应速率、平衡状态判断
点评:本题考查化学平衡计算、平衡常数计算、化学反应速率、平衡状态判断,难度中等,注意化学平衡状态判断,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
本题难度:困难
3、选择题 下图是在恒温密闭容器中进行的某化学反应的反应速率随时间变化的示意图。下列叙述与示意图不相不符的是 
[? ]
A、反应达平衡时,正反应速率和逆反应速率相等
B、该反应达到平衡态I后,增大反应物的浓度,平衡发生移动,达到平衡态II
C、该反应达到平衡态I以后,减小反应物浓度,平衡发生移动,达到平衡态II
D、同一种反应物在平衡态I和平衡态II时浓度不相等
参考答案:C
本题解析:
本题难度:一般
4、填空题 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3:2SO2(g)+ O2(g)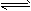 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题: 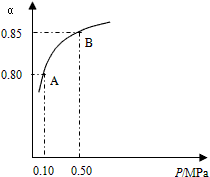
①将2.0molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_______________。
②平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用
NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4, M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示: 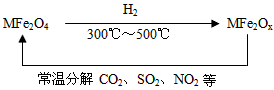
请写出MFe2Ox分解SO2的化学方程式____________________(不必配平)。
参考答案:(1)①800L/mol;②=
(2)1.60NA;173.4
(3)MFe2Ox+SO2→MFe2O4+S
本题解析:
本题难度:一般
5、选择题 在平衡体系Ca(OH)2(s)?Ca2++2OH-中,能使c(Ca2+)减小,而使c(OH-)增大的是( )
A.加入少量MgCl2固体
B.加入少量Na2CO3固体
C.加入少量KCl固体
D.加入少量Ca(OH)2固体
参考答案:A.镁离子与氢氧根离子反应生成氢氧化镁沉淀,平衡右移,c(Ca2+)减小,氢氧根离子的浓度降低,故A错误;
B.钙离子与碳酸根离子结合生成碳酸钙沉淀,平衡右移,c(Ca2+)减小,c(OH-)增大,故B正确;
C.加入少量KCl固体,对平衡移动无影响,c(Ca2+)、c(OH-)不变,故C错误;
D.加入少量氢氧化钙,平衡不移动,c(Ca2+)、c(OH-)不变,故D错误,
故选:B.
本题解析:
本题难度:简单