时间:2025-06-26 02:17:06
1、计算题 已知T°、pkpa时,在容积为vL的密闭容器内充有1molA和1molB。保持恒温、恒压反应A(g)+B(g)  C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2molA 2molB,则反应达到平衡时,容器的容积为 ,C的体积分数为 。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1molA和1molB反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为 。
参考答案:(1)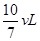 40% (2)
40% (2)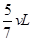
本题解析:(1)由于反应是在恒温恒压下进行的,而此时A和B的物质的量之比还是1
本题难度:困难
2、填空题 (13分)天然气的主要成分是甲烷,它是一种重要的燃料和基础化工原料。
(1)以甲烷和水为原料可制取甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ/mol
CO(g)+3H2(g) △H=+206.0kJ/mol
②CO(g)+2H2(g) CH3OH(g) △H=—129.0kJ/mol
CH3OH(g) △H=—129.0kJ/mol
则CH4(g)+H2O(g) CH3OH(g)+H2(g)的△H=__________kJ/mol。
CH3OH(g)+H2(g)的△H=__________kJ/mol。
(2)用甲烷催化还原NOx为N2可消除氮氧化物的污染,写出反应的化学方程式_______。
(3)一定条件下,反应CH4(g)+H2O(g) CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。
CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。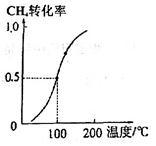
(4)某化学小组设计如图装置进行饱和NaCl溶液电解实验。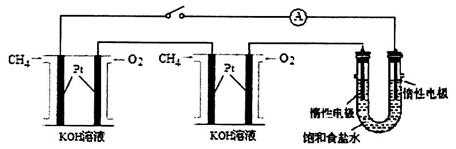
请回答下列问题:
已知每个甲烷燃料电池中盛有1.0L2.0 mol/L的KOH溶液。标准状况下,当每个燃料电池的负极通入甲烷的体积均为33.6L,且反应完全,则理论上电池溶液中c(K2CO3)_______c(KHCO3)(填“<”、“>”或“=”):最多能产生标准状况氯气的体积为________L。
参考答案:(1)+77.0 (2)xCH4+4NOx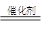 2N2+xCO2+2xH2O
2N2+xCO2+2xH2O
(3)0.003mol/(L·min);2.25×10—4(mol/L)2 > (4)< 134.4
本题解析:(1)已知①CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ/mol,②CO(g)+2H2(g)
CO(g)+3H2(g) △H=+206.0kJ/mol,②CO(g)+2H2(g) CH3OH(g) △H=—129.0kJ/mol,则根据盖斯定律可知①+②即得到CH4(g)+H2O(g)
CH3OH(g) △H=—129.0kJ/mol,则根据盖斯定律可知①+②即得到CH4(g)+H2O(g) CH3OH(g)+H2(g)的△H=+77.0kJ/mol。
CH3OH(g)+H2(g)的△H=+77.0kJ/mol。
(2)甲烷催化还原NOx为N2可消除氮氧化物的污染,反应中甲烷被氧化为CO2,所以反应的化学方程式为xCH4+4NOx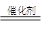 2N2+xCO2+2xH2O。
2N2+xCO2+2xH2O。
(3)已知100℃时达到平衡甲烷的转化率是0.5,则消耗甲烷0.5mol,同时消耗水蒸气0.5mol,生成CO和氢气分步是0.5mol和1.5mol,则氢气的浓度变化量是1.5mol÷100L=0.0015mol/L,所以用H2表示的反应速率v(H2)=0.0015mol/L÷5min=0.003mol/(L·min);平衡时甲烷、水蒸气、CO、氢气的浓度分别是0.0005mol/L、0.0015mol/L、0.0005mol/L、0.0015mol/L,则平衡常数K=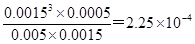 。升高温度甲烷的转化率增大,说明升高温度平衡向正反应方向碱性,因此正方应是吸热反应,该反应的△H>0。
。升高温度甲烷的转化率增大,说明升高温度平衡向正反应方向碱性,因此正方应是吸热反应,该反应的△H>0。
(4)消耗甲烷的物质的量是33.6L÷22.4L/mol=1.5mol,完全反应生成1.5molCO2。氢氧化钾的物质的量是2mol,则与甲烷生成的CO2反应生成碳酸钾和碳酸氢钾,设二者的物质的量分别是xmol、ymol,则x+y=1.5、2x+y=2,解得x=0.5、y=1.0,所以碳酸钾的物质的量小于碳酸氢钾。甲烷中碳元素的化合价是—2价,升高到+4价,失去4个电子,共计失去6mol电子,由于是两个氢氧燃料电池,则转移电子是12mol,共计电子得失守恒可知氯气的物质的量是12mol÷2=6mol,在标准状况下的体积是6mol×22.4L/mol=134.4L。
考点:考查盖斯定律、氧化还原反应、反应速率和平衡常数、外界条件对平衡状态的影响以及电化学原理应用等
本题难度:一般
3、填空题 氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g)?ΔH=-92.4 kJ·mol-1
2NH3(g)?ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
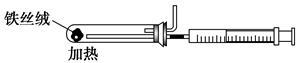
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。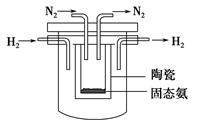
参考答案:(1)AD
(2)用湿润的红色石蕊试纸放在管口处,若试纸变蓝则说明有氨气生成
(3)该反应是可逆反应,10 mol N2与30 mol H2不可能完全反应,所以放出的热量小于10×92.4 kJ=924 kJ
(4)N2+6H++6e-=2NH3
本题解析:(1)勒夏特列原理只解释平衡移动问题。(2)根据氨的性质进行检验。(3)合成氨的反应是可逆反应。(4)根据合成氨反应中的氧化剂、电解池中阴极反应特点及电解质成分进行分析。
本题难度:一般
4、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( ? )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2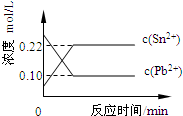
参考答案:D
本题解析:
本题难度:简单
5、选择题 在N2+3H2 2NH3的平衡体系中,当分离出NH3时,下列说法正确的是
2NH3的平衡体系中,当分离出NH3时,下列说法正确的是
[? ]
A.正反应速率增大
B.平衡向逆反应方向移动
C.正反应速率大于逆反应速率
D.逆反应速率先变小后变大
参考答案:CD
本题解析:
本题难度:一般