时间:2025-06-26 02:06:29
1、选择题 现有四种元素的基态原子的电子排布式如下:①1s22s22p63S23p4;②1s22s22p63s23p3;③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
[? ]
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
2、选择题 下列实验的操作、现象和解释或结论都正确的是
| ? | 操作 | 现象 | 解释或结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3晶体 |
| C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | Al3++3H2O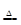 Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
| D | 将Na放入CuSO4溶液中 | 有红色固体析出 | 2Na+Cu2+=Cu+2Na+ |
3、推断题 (三选一)【物质结构与性质】
原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能?层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是___________,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)。
(2)根据等电子原理分析,BC2+?中B原子的轨道杂化类型是____________。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是____________。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第______电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为________;A能形成多种常见单质,在熔点最低的单质中,每个分子周围紧邻的分子数目为___________;?
(6)E的基态原子有_____种形状不同的原子轨道;E2+?的价电子排布式为_______;下图_______(填甲、乙或丙)表示的是E晶体中微粒的堆积方式。 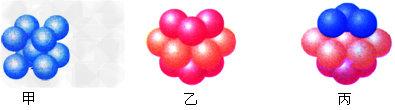
4、选择题 下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
① NaHCO3;? ② (NH4)2CO3;? ③ Al2O3;? ④ Al(OH) 3;? ⑤ Al
A.全部
B.①③④⑤
C.③④⑤
D.②③④⑤
5、选择题 下列叙述中正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数
B.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共18个纵行
C.除短周期外,其他周期均有18种元素
D.X2+的核外电子数目为18,则X在第三周期第ⅡA族