时间:2025-06-26 02:03:14
1、选择题 X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是(?)。
A.Y的阴离子Y 2-的还原性强于X的阴离子X-
B.X的含氧酸的酸性比Y的含氧酸的酸性强
C.X的单质X2能将Y的阴离子Y 2-氧化,并发生置换反应
D.X的氢化物比Y的氢化物稳定
参考答案:B
本题解析:A.元素的非金属性越强,其对应的阴离子的还原性就越弱。阴离子的还原性Y 2->X-。所以非金属性X>Y。正确。B.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。该选项中的物质的酸性不一定是最高价的含氧酸,因此酸性X>Y。所以不能说明非金属性X比Y强。错误。C.在氧化还原反应中活动性强的能把活动性弱的置换出来。由于发生反应X2+Y 2-→Y+2X-,所以非金属性X>Y。正确。D.元素的非金属性越强,其对应的氢化物的稳定性就越强。由于稳定性X的氢化物比Y的氢化物稳定,所以非金属性X>Y。正确。
本题难度:简单
2、填空题 根据反应:
2P+5Br2+8H2O=2H3PO4+10HBr
Cl2+2HBr=2HCl+Br2
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
(1)推断氧化性(氧化剂)由强到弱的顺序是? 。
(2)还原性(还原剂)由强到弱的顺序是? 。
参考答案:(1)KMnO4>Cl2>Br2?
(2)P>HBr>HCl
本题解析:
本题难度:一般
3、选择题 根据下列反应判断有关的物质氧化性由强到弱的顺序是( )
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3.
A.H2SO3>I->Fe2+>NO
B.HNO3>Fe3+>I2>H2SO4
C.HNO3>Fe3+>H2SO3>I2
D.NO>Fe2+>H2SO3>I-
参考答案:H2SO3+I2+H2O=2HI+H2SO4反应中碘得电子作氧化剂,亚硫酸失电子作还原剂,氧化产物是硫酸,所以氧化性I2>H2SO4;
2FeCl3+2HI=2FeCl2+2HCl+I2反应中氯化铁得电子作氧化剂,HI失电子作还原剂,氧化产物是碘,所以氧化性Fe3+>I2;
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3反应中HNO3得电子作氧化剂,FeCl2失电子作还原剂,氧化产物是Fe3+,所以氧化性HNO3>Fe3+;
所以这几种微粒氧化性强弱顺序是HNO3>Fe3+>I2>H2SO4,
故选B.
本题解析:
本题难度:一般
4、选择题 根据表中信息判断,下列选项不正确的是?
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2?、H?2SO4 | K2SO4 、MnSO4?...... |
| ② | Cl?2 、FeBr?2 | FeCl3、FeBr3 |
| ③ | MnO4- ?...... | Cl2 、Mn2+ ...... |
参考答案:D
本题解析:A、反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,生成氧气,根据H元素守恒可知还生成水,故A正确;B、由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B正确;C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1C12,转移电子为2mo1,故C正确;D、氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,故D错误。故选:D。
本题难度:一般
5、简答题 (1)写出一个能证明还原性Fe比Cu强的离子方程式:______;
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液?)______;
(3)若该电池中两电极的总质量为60g,工作一段时间后,取出两电极洗净干燥后称量,总质量为62g,则反应过程中转移电子的数目为______.
参考答案:(1)铁比铜的还原性强,可与Cu2+发生置换反应,反应的离子方程式为Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu;
(2)在Fe+Cu2+=Fe2++Cu反应中,Fe被氧化,应为原电池的负极,Cu2+得电子被还原生成单质Cu,正极材料为活泼性比Fe的金属如Cu或非金属材料,电解质溶液为含Cu2+离子的溶液,如CuCl2,故答案为: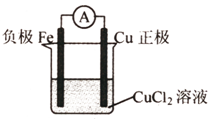
(3)设用xmolFe反应,根据电池总反应式计算,
Fe+Cu2+=Fe2++Cu△m
1mol? 8g
xmol?62g-60g=2g
x=0.25,
根据电极反应式可知Fe-2e-=Fe2+,转移的电子的物质的量为0.5mol,
反应过程中转移电子的数目为3.01×1023或0.5NA,故答案为:3.01×1023或0.5NA.
本题解析:
本题难度:一般