时间:2025-06-26 02:02:23
1、填空题 已知下列热化学方程式:①H2(g) +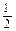 O2(g)=H2O(l) ΔH="-285" kJ·mol-1
O2(g)=H2O(l) ΔH="-285" kJ·mol-1
②H2(g) +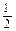 O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1?③C(s) +
O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1?③C(s) +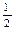 O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH="-393.5" kJ·mol-1?回答下列问题:
(1)H2的燃烧热为?;C的燃烧热为?。
(2)燃烧1gH2生成液态水,放出的热量为?。
(3)写出CO燃烧的热化学方程式?。
2、选择题 25℃时,将pH=3的HA溶液与pH=11的BOH溶液等体积混合,所得溶液pH小于7。下列说法不正确的是
A.HA为弱酸
B.混合溶液中加水稀释,pH升高,溶液导电能力减弱
C.等物质的量浓度等体积的NaA与NaCl溶液,溶液中的离子数目相等
D.混合溶液中滴加氨水至溶液的pH=7,所得溶液中c(A-)=c(NH)+c(B+)
3、填空题 (8分)(1)某温度(T℃)时,测得0.01 mol/L NaOH溶液的pH为11,则该温度下水的KW=________。则该温度________(填“大于”、“小于”或“等于”)25℃,其理由是___________________________________________________。
(2)此温度下,将pH=a的NaOH溶液Va L与pH=b的HCl溶液Vb L混合,若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=________。
4、选择题 常温下,在0.1 mol·L-1的CH3COOH溶液中,水的离子积是? ( )
A.1×10-14
B.1×10-13
C.1.32×10-14
D.1.32×10-15
5、选择题 己知:HCN(aq)与NaOH(aq)反应的△H="-12.1" kJ/mol;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/mol。则HCN在水溶液中电离的△H等于(?)
A.-67.7 kJ/mol
B.-43.5 kJ/mol
C.+43.5 kJ/mol
D.+67.7 kJ/mol