时间:2025-06-26 02:02:23
1、填空题 设水的电离平衡线如图所示。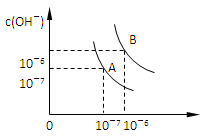
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到______。
(2)pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积 比为_________。
比为_________。
(3)若在某温度下,重水( D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
2、选择题 浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液,②氢氧化钠溶液 ③醋酸钠溶液,下列说法不正确的是( )
A.①和②等体积混合后的溶液中:c(OH-)=c(H+)+c(CH3COOH)
B.①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.②和③等体积混合后溶液中由水电离出的c(H+)<10-7 mol/L
D.由水电离出的c(OH-):②>③>①
3、选择题 下列说法正确的是
[? ]
A.?H2(g)的燃烧热△H=-285.8?kJ/mol,则2H2O(g)=2H2(g)+O2(g)?△H=+571.6?kJ/mol
B.?反应物的总能量低于生成物的总能量时,该反应为放热反应
C.?由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s)?△H<0?
D.?已知:298K时,N2(g)+3H2(g)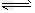 2NH3(g)?△H?=-92.0?kJ/mol。在相同温度下,向密闭容器中通入1/2?mol?N2和3/2?mol?H2,达到平衡时放出46.0?kJ的热量
2NH3(g)?△H?=-92.0?kJ/mol。在相同温度下,向密闭容器中通入1/2?mol?N2和3/2?mol?H2,达到平衡时放出46.0?kJ的热量
4、选择题 已知C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是
A.2CO(g) + O2(g) = 2CO2(g); △H= +282.8kJ/mol
B.2H2(g) + O2(g) = 2H2?O(g); △H= -571.6kJ/mol
C.C(石墨
D.s) + 1/2O2(g) =" CO(g);" △H= -110.7kJ/mol
E.燃烧前混合气体中,H2的体积分数为40%
5、填空题 2分)25℃,已知pH = 2的高碘酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;pH = 2的高锰酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。将可溶性的高碘酸钡[Ba5(IO6)2]与稀硫酸混合,发生反应的离子方程式为:____________。