时间:2025-06-26 01:59:56
1、简答题 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
(1)催化反硝化法中,H2能将NO3-还原为N2.25℃时,反应进行l0min,溶液的pH由7变为12.
①N2的结构式为______.
②上述反应的离子方程式为______,其平均反应速率v(NO3-)为______mol?L-1?min-1.
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法
______.
(2)电化学降解NO3-的原理如图所示.
①电源正极为______(填“A”或“B”),阴极反应式为:______.
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差______(△m左-△m右)为g.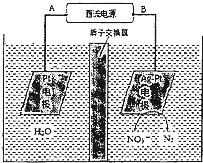
参考答案:(1)①N2分子中氮原子间通过氮氮三键结合,因此其结构式为N≡N,故答案为:N≡N;
②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式为:
2NO3-+5H2=N2+2OH-+4H2O,利用离子方程式知v(NO3-)=v(OH-)=10-2-10-710mol/(L?min)=0.001 mol/(L?min),
故答案为:2NO3-+5H2=N2+2OH-+4H2O,0.001;
③亚硝酸盐水解是吸热反应,且水解时生成氢氧根离子,稀释亚硝酸盐溶液能促进其水解,所以要使NO2-水解使溶液中c(OH-)变大,可促进NO2-水解的措施有加热、加水或加酸等,故答案为:加水、升高温度、加酸;
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,
所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:A,2NO3-+12H++10e-=N2+6H2O;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,
故答案为:14.4.
本题解析:
本题难度:一般
2、选择题 在相同条件下(T=500k),相同体积甲、乙两容器,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2.下列叙述错误的是
A.化学反应速率乙>甲
B.平衡后O2浓度乙>甲
C.SO2转化率乙>甲
D.平衡后SO2的体积分数乙>甲
参考答案:D
本题解析:
甲容器中充入1gSO2和1gO2;乙容器中充入2gSO2和2gO2,则乙容器压强大于甲容器压强,则
A.压强越大反应速率越大,乙容器压强大于甲容器压强,则化学反应速率:乙>甲,故A正确;
B.增大压强有利于平衡向正反应方向移动,则平衡后O2的浓度:乙>甲,故B正确;
C.增大压强有利于平衡向正反应方向移动,则SO2的转化率:乙>甲,故C正确;
D.乙可看作在甲的基础上缩小体积,压强增大,平衡向正反应方向移动,则平衡后SO2的体积分数:乙<甲,故D错误.
故选D.
本题难度:一般
3、简答题 (15分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |

| 实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | | t |
参考答案:(1)其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大(3分,每点1分)
(2)1.0×10-2 mol / (L·min) (2分)
(3) ①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)[2分,不指出MnSO4(或Mn2+)扣1分] ② MnSO4 (2分)
③ 与实验1比较,溶液褪色所需时间短(2分,不写“与实验1比较”扣1分) 或:所用时间(t)小于1.5min(或其他合理答案)
(4)2MnO42--2e-=2MnO4-(或 MnO42--e-=MnO4- ) (2分);
2K2MnO4+2H2O电解2KMnO4+2KOH+H2↑(2分)
本题解析:(1)根据表中数据可知,其他条件相同时,增大H2C2O4浓度(反应物浓度),反应速率增大。
(2)反应中消耗高锰酸钾的浓度是 =0.015mol/L,所以υ(KMnO4)=0.015mol/L÷1.5min=1.0×10-2 mol / (L·min)。
=0.015mol/L,所以υ(KMnO4)=0.015mol/L÷1.5min=1.0×10-2 mol / (L·min)。
(3)①由图2可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂.
②要验证假设作对比实验与与实验1比较,其它条件相同时加入MnSO4即可。
③如果假设成立,则加入硫酸锰以后若反应加快,溶液褪色的时间小于1.5min,说明Mn2+是催化剂.
(4)K2MnO4制取KMnO4,反应过程中Mn元素的化合价从+6价升高到+7价,因此锰酸钾在阳极放电,电极反应式为MnO42--e-=MnO4-,阴极是溶液中的氢离子放电产生氢气,所以总反应式为2K2MnO4+2H2O电解2KMnO4+2KOH+H2↑。
考点:考查反应速率计算、外界条件对反应速率的影响以及电解原理的应用
本题难度:一般
4、填空题 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。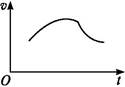
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率减慢的原因是 。?
参考答案:(1)2KClO3+6NaHSO3 3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大
3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大
(2)Cl和HS浓度减小
本题解析:该反应的实质为:Cl+3HS Cl-+3S+3H+
Cl-+3S+3H+
由题意知,反应随溶液中c(H+)的增大而加快,一开始c(H+)很小,速率很小,但随反应进行,c(H+)增大,反应速率增大,但到一定程度后,c(Cl)、c(HS)减小,此时反应物的浓度起主要作用,反应速率减小。
本题难度:一般
5、选择题 已知?4NH3(气)+5O2(气)=4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/L?min]表示,则正确的关系是( )
A.
| 4 5 |
| 5 6 |
| 3 2 |
| 5 4 |
参考答案:同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比.
A、V(NH3):V(O2)=4:5,54V(NH3)=V(O2),故A错误.
B、V(O2):V(H2O)=5:6,65V(O2)=V(H2O),故B错误.
C、V(NH3):V(H2O)=4:6=2:3,32V(NH3)=V(H2O),故C正确.
D、V(O2):V(NO)=5:4,45V(O2)=V(NO),故D错误.
故选C.
本题解析:
本题难度:一般