时间:2025-06-26 01:58:16
1、填空题 实验室用图I所示的装置制取干燥的氨气。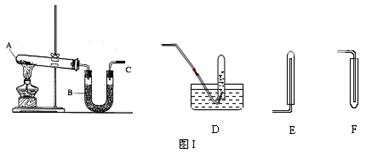
(1)A处反应的化学方程式为?。
(2)为收集到干燥的氨气,导管C应接?(填序号)。
(3)装置B中盛装的试剂的名称是?。
(4)在水槽中加入水(含酚酞),将充满氨气的试管倒置于放入水槽中(如图Ⅱ所示),将拇指稍移开试管口,可观察到的现象为_______________?。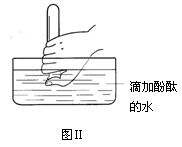
(5)在D、E、F三种气体收集方法中,能用于收集NO的是________(填写序号)。
2、选择题 将5.6 g的Mg?Cu混合物完全溶解于足量的硝酸中,收集反应产生的气体X。再向所得溶液中加入过量的NaOH溶液,产生10.7g沉淀。根据题意推断气体X的成分可能是
A.0.05 mol NO、0.15 mol NO2
B.0.2 mol NO2
C.0.15 mol NO
D.0.05 mol NO、0.1mol NO2、0.05 mol N2O4
3、选择题 下列关于砹(85At)及其化合物的说法中,正确的是(? )
A.稳定性:HAt>HCl
B.氧化性:At2>I2
C.At2为分子晶体
D.NaAt的水溶液呈碱性
4、选择题 某金属的硝酸盐加热分解生成的NO2和O2的物质的量之比为8∶1。在加热过程中,该金属元素的化合价(?)
A.降低
B.升高
C.不变
D.无法确定
5、选择题 下列结论正确的是( )?
A.酸性:H2SO4>HClO4>H2SO3?
B.酸性:HClO4>H2SO4>H2SO3?
C.氢化物的稳定性:HF>HCl>H2S>H2Te?
D.氢化物的稳定性:HF>H2S>HCl>H2Te?