时间:2025-06-26 01:58:16
1、选择题 含溶质的质量分数相同的浓氨水(密度ρ<1 g·mL-1)和浓NaOH(ρ>1 g·mL-1),各取50 mL分别与等体积水混合,所得稀氨水质量分数为a%,稀NaOH质量分数为b%,则a与b关系正确的是(?)
A.a>b
B.b>a
C.a="b"
D.不能确定
参考答案:B
本题解析:设混合前两溶液中溶质的质量分数为c%。由题意可知,b>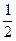 c,a<
c,a<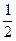 c。
c。
本题难度:简单
2、选择题 (本题共16分)将1.68克铁粉投入100mL稀硝酸中,两物质恰好完全反应,硝酸的还 原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。
根据题意完成第57~60题:
57.此硝酸的物质的量浓度范围是?;
58.a克固体的成份是?,质量为?克;
b克固体的成份是?,质量范围为?克。
59.假如反应中放出NO的体积(标况下)为582.4 mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为?。
60.已知:25℃时NaOH的溶解度为118克/100克水。25℃时,把15克NaOH固体溶解在一定量水中,配成20克溶液,其密度为1.44g/mL。用该溶液去沉淀铁与硝酸反应后的溶液中的全部铁元素,至少需要取该NaOH溶液?mL。
参考答案:(本题共16分)
57、[0.8 mol/L,1.2 mol/L](3分)
58、Fe2O3;2.4;NaNO2;[4.14,6.21] (6分)
59、0.504克(3分)
60、4.0.(4分)
本题解析:略
本题难度:一般
3、填空题 (12分)?回答下列问题: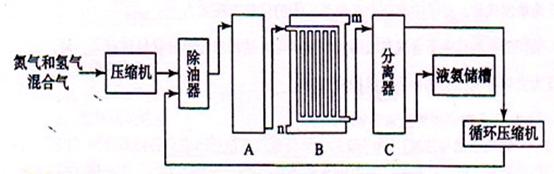
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 ?和将空气与碳反应后除去CO 2;氢气的来源是用水和碳氢化合物反应并产生CO, 写出采用天然气为原料制取氢气的化学反应方程式 ??。
(2)设备A中含有电加热器、触煤和热交换器,设备A中发生的化学反应方程式为 ;
(3) 设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。
(4)设备C的作用 ?;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)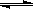 CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
(计算结果保留三位有效数字)
参考答案:(1)先加压液化再分馏(蒸馏) (2分); CH4+H2O CO+3H2?(2分)
CO+3H2?(2分)
(2) N2(g)+3H2(g) 2NH3?(2分)
2NH3?(2分)
(3)冷却塔(或冷凝器) (1分)? n (1分)
(4)将液氨与未反应的原料气分离(2分)
(5)13.8(2分)
本题解析:(1)分离两种气体的方法是先加压液化再分馏。利用天然气制备氢气则需甲烷和水反应,条件是催化剂。(2)A为反应室,装置提供高温催化剂的反应条件,即为氮气与氢气反应制备氨气的反应。(3)C后接液氨储存,C中需将液氨分离出来,所以B为冷却塔,为加大冷却效率,装置设计了很多回型管道。(4)将液氨与其他物质分离开。(5)设CO、H2O起始浓度为x、ymol/L,则转化的CO的最小值为0.9x。
CO(g)+H2O(g) =? CO2(g)+H2(g)
起始? x? y?0? 0?
变化? 0.9x? 0.9x? 0.9x? 0.9x
平衡? 0.9x? y-0.9x? 0.9x? 0.9x?
根据平衡常数列式:(0.9x)2/0.1x(y-0.9x)=0.627?解得?y/x=13.8。所以只要此值大于13.8,转化率就会超过90%。
点评:此题以合成氨反应为载体?综合考查了化学与技术模块的主干知识。
本题难度:一般
4、选择题 对于下列事实的解释错误的是?
[? ]
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.氮元素是活泼的非金属元素,因此氮气的化学性质也很活泼
D.氨水可使酚酞试剂变为红色,说明氨溶解于水显碱性
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列各组物质:①C+O2,②NH3·H2O +SO2,③Cu+HNO3,④Cl2 +FeBr2,⑤Fe+HCl,⑥Zn+ H2SO4,⑦NaHCO3+HCl,⑧Fe +Cl2,在不同条件下(浓度、温度或用量)反应,能得到不同产物的是
[? ]
A.①②③④⑥
B.①②③④⑤⑥⑦⑧
C.②④⑥⑧
D.①③⑤⑦
参考答案:A
本题解析:
本题难度:简单