时间:2025-06-26 01:57:30
1、填空题 高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
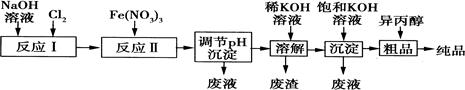
参考答案:(1)①Cl2+2NaOH=NaCl+NaClO+H2O(2分);
②2Fe3++3ClO—+10OH—=2FeO42—+3Cl—+5H2O(2分);
③pH=3(2分);
(2)①强;②小
(3)有强氧化性,能杀菌消毒,产生Fe(OH)3有吸附性(2分);(4)3:1(2分)
本题解析:①由湿法制备高铁酸钾的原理,结合流程可知:反应I:2NaOH+Cl2
本题难度:困难
2、选择题 下列表示对应化学反应的离子方程式正确的是
A.硫化钠溶于水中:S2-+2H2O H2S+2OH-
H2S+2OH-
B.醋酸溶解鸡蛋壳:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+ H2O
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O
参考答案:B
本题解析:A、硫化钠溶于水中,S2-分步水解,以第一步水解为主,应为:S2-+H2O HS-+OH-,错误;B、醋酸溶解鸡蛋壳:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+ H2O,错误;C、NaHCO3溶液与稀H2SO4反应应为:HCO3-+H+=H2O+CO2↑,错误;D、NH4HCO3溶液与足量的NaOH溶液反应应为:NH4++HCO3-+2OH-=CO32-+H2O+NH3·H2O,错误。
HS-+OH-,错误;B、醋酸溶解鸡蛋壳:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+ H2O,错误;C、NaHCO3溶液与稀H2SO4反应应为:HCO3-+H+=H2O+CO2↑,错误;D、NH4HCO3溶液与足量的NaOH溶液反应应为:NH4++HCO3-+2OH-=CO32-+H2O+NH3·H2O,错误。
考点:考查离子方程式正误判断。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca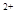 +2ClO
+2ClO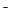 =CaCO3↓+2HClO
=CaCO3↓+2HClO
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO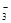 =CO
=CO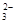 +H2O
+H2O
C.Fe3O4与稀HNO3反应:Fe3O4+8H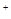 =Fe
=Fe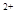 +2Fe
+2Fe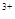 +4H2O
+4H2O
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO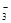 +Ca
+Ca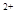 +OH
+OH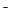 =CaCO3↓+H2O
=CaCO3↓+H2O
参考答案:B
本题解析:A.将过量的CO2通入Ca(ClO)2溶液中生成次氯酸和碳酸氢钙,离子方程式错误,A错误;B.将少量NaOH溶液加入到NH4HCO3溶液中生成碳酸钠、碳酸铵和水,B正确;C.硝酸具有强氧化性,Fe3O4与稀HNO3反应生成硝酸铁、NO和水,离子方程式错误,C错误;D.向NaHCO3溶液中加入少量Ca(OH)2生碳酸钙、碳酸钠和水,离子方程式错误,D错误,答案选B。
考点:考查离子方程式的正误判断
本题难度:一般
4、选择题 下列反应的离子方程式正确的是
A.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-= NH3↑+H2O
B.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2=2Fe3++2Cl-
C.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-
参考答案:B
本题解析:A错,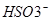 也要与氢氧化钠溶液反应;B正确;C错,氢氧化铜能与过量的氨水反应;D错,正确为Ca2++HCO3-+OH-==CaCO3↓+2H2O;
也要与氢氧化钠溶液反应;B正确;C错,氢氧化铜能与过量的氨水反应;D错,正确为Ca2++HCO3-+OH-==CaCO3↓+2H2O;
本题难度:一般
5、选择题 下列离子方程式中,正确的是
A.稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑
B.碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C.硫酸铜溶液与氢氧化钠溶液混合:CuS04+20H-=Cu(OH)2↓+SO42-
D.硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+N03-
参考答案:B
本题解析:A.铁与稀硫酸反应生成亚铁离子,错误;B.正确;C.硫酸铜是可溶性的盐,应该是Cu2++20H-=Cu(OH)2↓,错误;D.硝酸银是可溶性的盐,应该是Ag++Cl-=AgCl↓,错误;选B。
考点:考查离子方程式的正误判断。
本题难度:一般