时间:2025-06-26 01:55:00
1、选择题 美国在科索沃战场上投下了至少10t贫铀弹.贫铀弹的主要成分是低放射性的铀238,它与制造原子弹的铀235属于( )
A.同系物
B.同位素
C.同分异构体
D.同素异形体
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | FeCl3溶液能腐蚀Cu | Fe的金属性强于Cu |
| B | Na2O2使酚酞溶液变红 | Na2O2使品红溶液褪色 |
| C | Cl2可部分与水反应 | 用排饱和食盐水法收集Cl2 |
| D | 浓H2SO4可干燥NO和SO2 | NO和SO2还原性都弱 |
参考答案:C
本题解析:A、FeCl3溶液能腐蚀Cu,发生的反应为:2Fe3++Cu=2Fe2++Cu2+,与Fe的金属性强于Cu无关;B、Na2O2使酚酞溶液先变红后褪色,错误;C、Cl2可部分与水反应,饱和食盐水中Cl?浓度大,降低了Cl2的溶解度,所以用排饱和食盐水法收集Cl2,正确;D、浓硫酸可干燥SO2,是因为浓硫酸中的S元素为+6价,SO2中的S元素为+4价,二者不能发生氧化还原反应,错误。
本题难度:一般
3、选择题 XY2是离子化合物,X和Y的离子的电子层结构与氖原子的相同,则X、Y为
A.Na和Cl
B.K和S
C.Ca和F
D.Mg和F
参考答案:D
本题解析:试题分析:XY2是离子化合物,X和Y的离子的电子层结构与氖原子的相同,由于Ne是10电子微粒,而X和Y的化合价分别是+2价和-1价或+4价和-2价,因此符合条件的X、Y为Mg和F,答案选D。
考点:考查核外电子排布、元素种类的判断
点评:该题的关键是明确Ne原子的核外电子排布特点,然后依据X和Y的化合价逐一分析和判断即可,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:简单
4、填空题 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX ; Y、M同主族,可形成MY2、MY3两种分子。
(1)Y在元素周期表中的位置为 ?。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 ?(写化学式),非金属气态氢化物还原性最强的是 ?(写化学式)。
(3)X、Y、Z、M组成两种盐的溶液反应可产生MY2气体,写出其反应离子方程式: ?
(4)M的氧化物与G的单质的水溶液均有漂白性,相同条件下,相同体积的M的氧化物与Y的单质混合通入品红溶液,品红溶液 (填褪色或不褪色),原因(用化学方程式表示) ?
参考答案:(1)第二周期VIA族?(2)HClO4?H2S?(3)HSO3-+H+ = SO2↑+ H2O
(4)不褪色 ; Cl2+SO2 +2H2O =H2SO4 +2HCl
本题解析:(1)由题意可知X是H、Y是O、Z是Na、M是S、G是Cl;则Y在元素周期表中的位置是位于第二周期VIA族,(2)由于非金属性最强的元素是Cl,所以其最高价氧化物对应的水化物酸性最强的是HClO4而非金属气态氢化物还原性最强的是H2S。(3)MY2为SO2则由着四种元素组成的这两种盐为NaHSO4和NaHSO3而NaHSO4在水溶液中可电离出H+起一元强酸的作用,反应的离子方程式为:HSO3-+H+ = SO2↑+ H2O。(4) )M的有漂白性的氧化物为SO2、G的单质为Cl2。因为SO2有还原性 、Cl2有氧化性。若按照1:1的物质的量的比混合,在水中发生恰好氧化还原反应Cl2+ SO2+ 2H2O=2HCl+H2SO4.产生没有漂白性的HCl和H2SO4,因而失去漂白能力。2、Cl2的漂白性、H2S还原性等性质的知识。
本题难度:一般
5、填空题 (18分)某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤: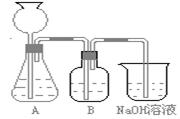
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程____________________、____________________________。
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检查整个装置的气密性______________________________________。
(3)装置B中盛放的试剂是______________,
作用是___________________? ____________。
(4)在实验室通常制法中,装置A还可作为下列_____________ 气体的发生装置(填序号)。
①CH2==CH2?②H2S?③CH4?④CH≡CH?⑤H2 (5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。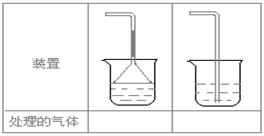
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________。
参考答案:(1) 2NaOH + CO2 ="=" NaHCO3? NaHCO3 + NaOH ="=" Na2CO3 + H2O?
(2)方法①:用弹簧夹夹住A、B连接处,先检查A的气密性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气。然后检查B的气密性:向烧杯中注入少量水,使导管口侵入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气。
方法②:也可一次检查A、B的气密性:连接和烧杯间的乳胶管用止水夹夹住。然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气。?
(3) 饱和酸氢钠溶液?吸收HCl气体
(4) ②④⑤? (5) ①③?②④? (6) 7.2 mol/L
本题解析:略
本题难度:简单