时间:2025-06-26 01:53:25
1、填空题 (10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 ? B. H2O2? ?C. Cl2水? ?D. HNO3?
? B. H2O2? ?C. Cl2水? ?D. HNO3?
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH?B. NH3·H2O?C. CuO?D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_____ ___,
___, 通过计算确定上述方案________(填“可行”或“不可行”)。
通过计算确定上述方案________(填“可行”或“不可行”)。
参考答案:
本题解析:略
本题难度:一般
2、填空题 (12分)(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据: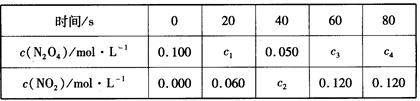
①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
A.增大容器的容积
B.再充入一定量的N2O4
C.再充入一定量的NO2
D.再充入一定量的He
(3)常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液,消耗盐酸的体积分别为V1、V2,则V1_____V2(填“>”“<”或“=”下同);
②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,消耗盐酸的体积分别为V3、V4,则V3_____V4;
③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,最后溶液均为中性,消耗盐酸的体积分别为V5、V6,则V5_____V6。
参考答案:(1)CH4(g) +2O2 (g)→CO2(g)+2H2O(l);△H="-890.3" kJ/mol;
(2) ①0.36; ②0.001 mol/(L·s); ③B、C; (3)>; =; <。
本题解析:(1)356g“可燃冰”的物质的量是356g÷178g/mol=2mol。则其中含有的甲烷的物质的量是2mol,能放出1780.6 kJ的热量,则1mol的甲烷完全燃烧产生稳定的化合物时所放出的热量是1780.6 kJ÷2mol=890.3 kJ.甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=-890.3 kJ/mol; (2) ①从表中分析:该反应达到平衡时N2O4的平衡浓度是0.04mol/L、NO2平衡浓度是0.12mol/L,则反应的平衡常数为K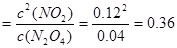 ;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)=
;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)=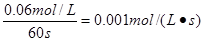 ; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
考点:考查热化学方程式的书写、化学平衡常数、化学反应速率的计算、酸碱中和反应时体积关系的计算。
本题难度:困难
3、选择题 下列关于配制一定物质的量浓度的溶液说法正确的是(?)
A.把40gNaOH溶解于1L水中即得到1mol/L的的NaOH溶液
B.将4.48LNH3溶解于水配成1L溶液即得到0.2mol/L的氨水溶液
C.配制0.2mol/L的的CuSO4溶液480mL,需硫酸铜晶体的质量为25g
D.配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,则配出浓度偏高
参考答案:C
本题解析:A、40gNaOH的物质的量为1mol,物质的量浓度=溶质的物质的量/溶液的体积,题中,只涉及溶剂的体积,未涉及溶质的体积,故无法计算。
B、没有讲明在标况下,故不能计算NH3的物质的量,故无法计算。
C、一定物质的量溶液的配制,其所用的容量瓶具有一定的规格,因此是无法配得任意体积的一定物质的量浓度的溶液的.此题中欲配制0.2mol/L的的CuSO4溶液480mL,应取用500mL容量瓶,所需CuSO4的物质的量为0.2×0.50=0.10mol,即16.00g,而硫酸铜晶体中,CuSO4的的质量分数为(160g/250g)=0.64,故所需硫酸铜晶体的质量为16.00g÷0.64=25g,故正确.
D、加水定容时仰视刻度线,会使增加的溶剂变多,从而使配制的实际浓度偏低。
点评:此题考核了物质的量浓度的计算,要掌握,物质的量浓度=溶质的物质的量/溶液的体积,同时,要注意题中的字眼,像C选项中,最后计算的是需要硫酸铜晶体(CuSO4.H2O)的质量,而不是硫酸铜,审题要仔细。
本题难度:简单
4、选择题 下列叙述正确的是
A.c(NH)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.0.2 mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.0.2 mol·L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO)+c(OH-)
参考答案:A
本题解析:略
本题难度:一般
5、选择题 在80 ℃时,水的离子积KW=3.8×10-13,该温度时纯水的pH(?)
A.等于7
B.小于7
C.大于7
D.无法确定
参考答案:B
本题解析:纯水呈中性,c(H+)=c(OH-),即使升温至80 ℃时,仍为c(H+)=c(OH-),所以有KW=c(H+)·c(OH-)=[c(H+)]2=3.8×10-13,c(H+)=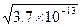 ?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
本题难度:简单