时间:2025-06-26 01:53:25
1、实验题 (12分)某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要??。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ.用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号)?,该错误操作会导致测定结果?(填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应?:判断滴定终点的现象是?。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果?(填“偏大”、“偏小”或“无影响’")。
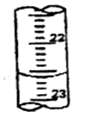
(3)按正确操作测得有关数据记录如下:
| ? 滴定次数 | ? 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
参考答案:(12分)(1) 500ml容量瓶(1分)? (2)①Ⅰ(2分)?偏大(1分)?
②注视锥形瓶中溶液颜色的变化(1分)?
溶液由红色刚好变为无色,且半分钟内不变色(2分)
③偏小(1分)? (3) ①22.60(2分)?②80.8%(2分)
本题解析:(1) 配制500ml溶液时,需要500ml容量瓶,所以还需要500ml容量瓶。
(2)①滴定管用水洗涤后,还需要用标准液润洗,否则相当于稀释溶液,因此盐酸的浓度降低,消耗的盐酸溶液体积偏大,则测定结果偏高。
②步骤Ⅳ中滴定时眼睛应注视锥形瓶中溶液颜色的变化。由于选择的指示剂是酚酞,所以终点时的现象是溶液由红色刚好变为无色,且半分钟内不变色。
③若步骤II中仰视读数,则读数偏大。步骤Ⅳ中俯视读数,读数偏小,所以消耗溶液的体积偏少,因此测定结果偏小。
(3)根据滴定管的结构可知,此时的读数应该是a=22.60ml。根据表中数据可知,三次实验中消耗盐酸的体积是20.18ml、20.20ml、20.22ml,所以三次实验的平均值是20.20ml,则氢氧化钠的物质的量是0.00202mol,则纯度是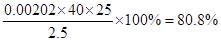 。
。
点评:判断中和滴定中的误差分析的总依据为:由C测==C标V标/V测。由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小。根据产生误差的来源,从以下几个方面来分析:①洗涤误差;②读数误差;③气泡误差;④锥形瓶误差;⑤变色误差;⑥样品中含杂质引起的误差等,需要具体问题具体分析。
本题难度:一般
2、选择题 常温下取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为(?)
A.0.01 mol?L-1
B.0.017 mol?L-1
C.0.05 mol?L-1
D.0.50 mol?L-1
参考答案:C
本题解析:考查pH的有关计算。根据题意氢氧化钠是过量的,反应后溶液中OH-的浓度是0.01mol/L,所以有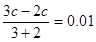 ,解得c=0.05mol/L,答案选C。
,解得c=0.05mol/L,答案选C。
本题难度:一般
3、选择题 已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-890kJ/mol
B. CH4(g)+O2(g)=
CH4(g)+O2(g)=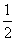 CO2(g)+H2O(l);△H=-445kJ/mol
CO2(g)+H2O(l);△H=-445kJ/mol
C.
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-55.625kJ/mol
参考答案:D
本题解析:题目中给出的数据意义是:燃烧1g的甲烷放出55.625kJ的热量,应该换算成燃烧1mol甲烷放出的热量为890kJ。热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ·mol-1其他系数与热量相对应的方程式均正确。
本题难度:简单
4、选择题 下列各种说法中,都包含有前后两个数值,其中前者大于后者的是(?)
A.在25℃和80℃时纯水中的c(H+)浓度
B.室温时,浓度均为 0.1mol/L的(NH4)2SO4(aq)、(NH4) 2CO3 (aq)的c(NH4+)
C.25℃时,pH均为3的HCl和NH4Cl溶液中水的电离程度
D.1 L饱和氯化铵溶液中NH4+和Cl- 的个数
参考答案:B
本题解析:水解过程为吸热过程,温度升高,平衡向正发现移动,所以在25℃和80℃时纯水中的c(H+)浓度应该是前者小于后者,故A不能选;(NH4)2SO4(aq)、(NH4) 2CO3 (aq)中,因为(NH4) 2CO3 (aq)中发生双水解,促进了水解,所以c(NH4+) 为前者大于后者,所以B可以选;pH均为3的HCl和NH4Cl溶液中,HCl抑制了水的电离,而NH4Cl溶液却促进了水的电离,所以水的电离程度为前者小于后者,故C不能选;由于NH4Cl中,铵根离子发生了水解,所以1 L饱和氯化铵溶液中NH4+和Cl- 的个数为前者小于后者,故D不能选,所以本题的答案为B。
点评:本题考查了水的电离,盐类水解,该考点是高考考点的重点和热点,本题有一定的综合性,难度适中。
本题难度:简单
5、选择题 对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1 mL稀释至100 mL后,? pH="3"
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为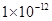
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A.①②
B.①③
C.②④
D.③④
参考答案:A
本题解析:硝酸是强酸,稀释100倍后溶液的pH增大2个单位,①正确;硝酸和氢氧化钡都是强酸和强碱,且溶液中氢离子和OH-浓度都是相等的,二者恰好反应,溶液显中性,②正确;溶液中水电离出的c(H+)就等于溶液中OH-浓度,所以根据水的离子积常数可知,该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为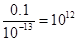 ,③不正确;④不正确,此时二者恰好反应,但生成的氯化铵水解,溶液显酸性,答案选A。
,③不正确;④不正确,此时二者恰好反应,但生成的氯化铵水解,溶液显酸性,答案选A。
点评:在判断中和反应后溶液的酸碱性时,应该首先判断酸或碱的过量问题。只有当酸或碱恰好反应时,才能考虑生成的盐是否水解。
本题难度:一般