时间:2025-06-26 01:50:57
1、选择题 通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同, 则下列有关说法中正确的是
[? ]
A.CH4和NH4+是等电子体,键角均为60°
B.NO3-和CO32-是等电子体,均为平面正三角结构
C.H3O+和PCl3是等电子体,均为三角锥结构
D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
2、选择题 某离子晶体晶胞结构如图2-15所示,图中X位于立方体的顶点,Y位于立方体中心.晶体中距离最近的2个X与一个Y形成的夹角∠XYX的角度为?( ?)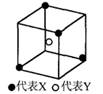
A.109°28′
B.107°18′
C.90°
D.120
3、填空题 氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为___________。
(2)根据等电子原理,CO与N2互为等电子体,请写出CO分子结构式___________。
(3)在极性分子NCl3中,N元素的化合价为-3,Cl元素的化合价为+1,请推测NCl3水解的主要产物是
___________ (填化学式)。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___________。
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是
_____________,与同一个N3-相连的X+有__________个。 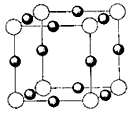
4、填空题 填表:
5、简答题 在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中:
(1)以极性键相结合,具有正四面体结构的非极性分子是______.
(2)以极性键相结合,具有三角锥型结构的极性分子是______.
(3)以极性键相结合,具有V型结构的极性分子是______.
(4)以极性键相结合,而且分子极性最大的是______.
(5)CO32-的空间构型为______.