时间:2025-06-26 01:45:14
1、选择题 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应。下列说法不正确的是?
A.所用醋酸溶液的浓度大于所用氢氧化钠溶液的浓度
B.两溶液混合反应后的所得的混合溶液呈碱性
C.原醋酸溶液中有1%的醋酸已电离
D.反应后的溶液中CH3OO-与CH3COOH两种微粒的平衡浓度之和为0.05mol?L-1
参考答案:A
本题解析:醋酸溶液与氢氧化钠溶液等体积混合后恰好完全反应,由于二者是一元酸与一元碱的反应,所以醋酸与氢氧化钠溶液的浓度应该相等,A错误;恰好完全反应所得的溶液应该是醋酸钠溶液,由于醋酸根离子发生水解所以溶液呈碱性,B正确;假设体积均为1L,所以可以计算出混合前醋酸的浓度为0.1mol?L-1,根据其PH可以计算出电离出的氢离子浓度为0.001mol?L-1,醋酸的电离度为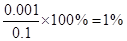 ,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
本题难度:一般
2、选择题 下列溶液中氯离子浓度最大的是?(?)
A.2mol/L 500mLMgCl2溶液
B.2.5mol/L 1000mLNaCl溶液
C.1mol/L 250mLAlCl3溶液
D.5mol/L 300mLKClO3溶液
参考答案:A
本题解析:溶液的浓度与溶液的体积多少无关,所以A中氯离子的浓度为4 mol/L;B中氯离子的浓度为2.5 mol/L;C中氯离子的浓度为3 mol/L;D中氯离子的浓度为0;所以正确选项为A;
本题难度:简单
3、填空题 中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在平衡:H2O H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是?(填字母)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是?(填字母)。
A.向水中加入NaHSO4
B.向水中加入Cu(NO3)2
C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.在水中加入(NH4)2SO4
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显?色,溶液呈?性(填“酸”、“碱”或“中”);若用pH计测定,则pH?7(填“>”、“<”或“=”),溶液呈?性(填“酸”、“碱”或“中”)。
参考答案:(1)BD (2)淡黄 中 < 中
本题解析:(1)要使平衡右移,且所得溶液呈酸性,应减少OH-的量,所以选B、D。(2)100 ℃时,pH=6溶液呈中性,因此用pH计测定时,pH应小于7,因为溶液是中性,所以pH试纸呈淡黄色。
本题难度:一般
4、选择题 下列实验对应的图象正确的是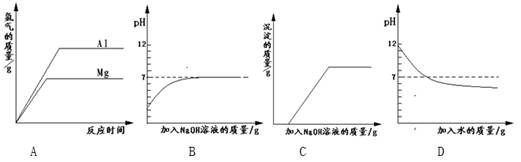 ?
?
A.将等质量的镁和铝分别与足量的盐酸反应
B.向pH=2的盐酸中滴加过量的氢氧化钠溶液
C.向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液
D.向pH=12的氢氧化钠溶液中加水稀释
参考答案:C
本题解析:A项:镁比铝活泼,镁的图线角度要大,故错;B项:氢氧化钠过量,最终溶液呈碱性,故错;D项:碱稀释不会变成酸,故错。故C。
点评:本题考查的是化学图像综合分析的相关知识,题目难度不大,注意碱再稀释也不会变成算。
本题难度:简单
5、选择题 下列各物质投入水中,因促进水的电离而使溶液呈酸性的是?
A.HCl
B.NaHSO4
C.Na2SO4
D.NH4Cl
参考答案:D
本题解析:加入能水解的盐,促进水的电离。水解中谁强显谁性;故加入强酸弱碱盐,答案为D。
本题难度:简单