时间:2025-06-26 01:45:14
1、选择题 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应。下列说法不正确的是?
A.所用醋酸溶液的浓度大于所用氢氧化钠溶液的浓度
B.两溶液混合反应后的所得的混合溶液呈碱性
C.原醋酸溶液中有1%的醋酸已电离
D.反应后的溶液中CH3OO-与CH3COOH两种微粒的平衡浓度之和为0.05mol?L-1
2、选择题 下列溶液中氯离子浓度最大的是?(?)
A.2mol/L 500mLMgCl2溶液
B.2.5mol/L 1000mLNaCl溶液
C.1mol/L 250mLAlCl3溶液
D.5mol/L 300mLKClO3溶液
3、填空题 中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在平衡:H2O H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是?(填字母)。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是?(填字母)。
A.向水中加入NaHSO4
B.向水中加入Cu(NO3)2
C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.在水中加入(NH4)2SO4
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显?色,溶液呈?性(填“酸”、“碱”或“中”);若用pH计测定,则pH?7(填“>”、“<”或“=”),溶液呈?性(填“酸”、“碱”或“中”)。
4、选择题 下列实验对应的图象正确的是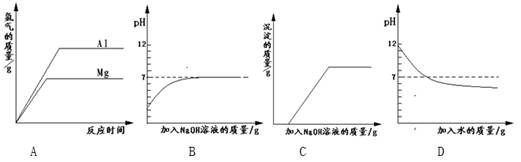 ?
?
A.将等质量的镁和铝分别与足量的盐酸反应
B.向pH=2的盐酸中滴加过量的氢氧化钠溶液
C.向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液
D.向pH=12的氢氧化钠溶液中加水稀释
5、选择题 下列各物质投入水中,因促进水的电离而使溶液呈酸性的是?
A.HCl
B.NaHSO4
C.Na2SO4
D.NH4Cl