时间:2025-06-26 01:42:46
1、选择题 一定温度下改变反应容器体积使压强变化,但不会使下列化学反应的平衡发生移动的是( )
A.2SO2(g)+O2(g)?2SO3(g)
B.2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)
C.C(s)+CO2(g)?2CO(g)
D.Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
2、选择题 在一定温度下,对于可逆反应C(s)+H2O(g) CO(g)+H2(g),其平衡常数表达式正确的是?
CO(g)+H2(g),其平衡常数表达式正确的是?
[? ]
A.K=[c(C)·c(H2O)]/?[c(CO)·c(H2)]?
B.K=?[c(CO)·c(H2)]/?[c(C)·c(H2O)]?
C.K=[c(H2O)]/?[c(CO)·c(H2)]?
D.K=[c(CO)·c(H2)/?[c(H2O)]]
3、选择题 在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)?
?4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
A.若当温度升高后,则图中θ>45°
B.若再加入B,则正、逆反应速率均逐渐增大
C.若再加入B,则再次达到平衡时反应体系气体密度减小
D.平衡时B的转化率为50%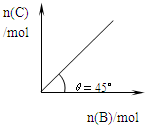
4、选择题 能确认发生了化学平衡移动的是 ( )
A.化学反应速率发生了变化
B.物质的浓度发生了变化
C.有气体参加的可逆反应达平衡后,对容器的压强增大
D.由于某一条件的改变,平衡混合物中各组分物质的浓度发生了不同程度的改变
5、选择题 在密闭容器中发生下列反应;aA(g)?cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是( )
A.平衡向正反应方向移动了
B.平衡向逆反应方向移动了
C.A的转化率增大
D.正、逆速率都增大