时间:2025-06-26 01:41:58
1、选择题 将a?g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b?g?(?a>b?)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
A.
B.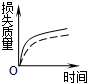
C.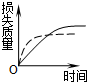
D.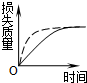
2、选择题 下列说法正确的是?
[? ]
A.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
3、填空题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中的化学方程式有______;______.
(2)硫酸铜溶液可以加快氢气生成速率的原因是______;
(3)实验室中现有Na2SO4、Ag2SO4、MgSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是______;
(4)要加快上述实验中气体产生的速率,还可采取的措施有(答一种即可):______.
4、选择题 恒温密闭容器中,某反应的化学反应速率随时间变化关系如图所示,下列说法不符合该图示的是( )
A.达到平衡时,正逆反应速率相等
B.增大反应物的浓度,反应由平衡I变化到平衡II
C.反应达到平衡I以后,减小反应物浓度,平衡移动到II
D.反应达到平衡II时的化学反应速率比平衡I时的大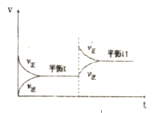
5、选择题 某学生将干燥的碘粉与铝粉混合时未见反应,但滴上一滴水会冉冉升起紫色的碘蒸气,最后得到白色固体.有关该实验的解释合理的是( )
A.加水使碘和铝粉形成溶液
B.水作氧化剂
C.该反应是吸热反应
D.水是催化剂