时间:2025-06-26 01:41:58
1、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
[? ]
A.加入少量稀NaOH溶液?
B.加入少量CH3COONa固体
C.加入少量CuSO4固体?
D.升温
2、实验题 (1)已知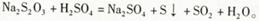 甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):
甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时问,可探究_____对化学反应速率的影响。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。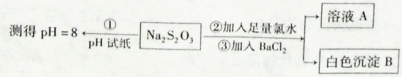
用离子方程式表示Na2S2O3溶液具有碱性的原因_______,实验操作①中测试时pH试纸的颜色应该接近 _______。
A.红色
B.深蓝色
C.黄色
D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的______性。
3、选择题 下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是( )
| 试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 A 常温 3% -- B 水浴加热 3% -- C 水浴加热 6% MnO2 D 常温 6% -- |
4、实验题 化学是以实验为基础的学科。利用已学知识对下列实验进行分析并填空:
Ⅰ.(8分) 某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去)。A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。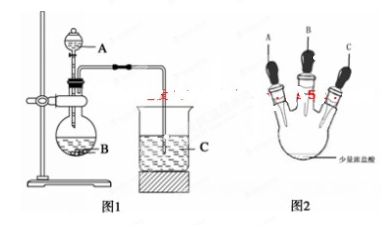
(1)甲同学设计实验所涉及的离子方程式为 、
;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应。写出该操作中主要离子方程式为 。
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到 ;
(3)根据甲乙同学的实验可得到的结论是: 。
II.(6分) 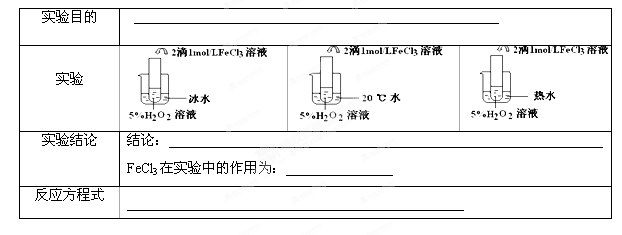
5、选择题 下列条件:①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④不断分离出生成物 ⑤加入MnO2,
一定能使反应速率增大的是( )
A.②
B.②③
C.①②⑤
D.全部