时间:2025-06-26 01:40:21
1、选择题 在101 kPa和25℃时,有反应的热化学方程式
H2(g) + 1/2O2(g) =H2O(g)? △H=-241.8 kJ/mol
H2(g) + 1/2O2(g) =H2O(1)? △H=-285.8 kJ/mol
下列说法中错误的是:
[? ]
A.H2燃烧生成1mol H2O(g)时,放出241.8kJ的热量
B.H2的燃烧热为285.8kJ
C.O2前面的1/2表示参加反应的O2的物质的量
D.1mol液态水变成水蒸气时吸收44kJ的热量
参考答案:B
本题解析:
本题难度:简单
2、填空题 (14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=—566kJ?moL-1
2H2(g)+O2(g)=2H2O(g) △H=—483.6kJ?moL-1
H2O(g)=H2O(l) △H=—44.0kJ?moL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol
2NH3(g) △H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。
①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是:
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。
当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
参考答案:(每空2分,共14分)(1)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
(2)①升温 t2-t3 ②4 ③c a
(3)c(Cl-)>c(NH4+)>c(H+)>c(OH-) (顺序正确得2分,顺序有误不得分)
本题解析:(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=—566kJ?moL-1,②2H2(g)+O2(g)=2H2O(g)△H=—483.6kJ?moL-1,则根据盖斯定律可知(①—②)÷2即可得到CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol
2NH3(g) △H=—92.4kJ/mol
①t3时正逆反应速率均增大,其中逆反应速率大于正反应速率,平衡向逆反应方向进行。由于正方应是体积减小的放热的可逆反应,则引起平衡移动的条件是升高温度。平衡向正反应方向进行,氨气的含量高,因此根据图像可知表示平衡混合物中NH3的含量最高的一段时间是t2-t3。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则根据方程式可知生成氨气是0.5mol×2=1.0mol,剩余氨气0.5mol,氢气2mol—1.5mol=0.5mol,则反应在T℃时的平衡常数为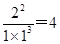 mol-2·L2。
mol-2·L2。
③目前工业合成氨的原理是: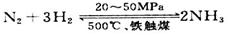
图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,增大压强平衡向正反应方向进行,氨气的含量升高,所以变化趋势正确的是c;当横坐标为温度时,升高温度平衡向逆反应方向进行,氨气的含量降低,则变化趋势正确的是a。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,二者恰好反应生成氯化铵,铵根水解溶液显酸性,则所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为c(Cl-)>c(NH4+)>c(H+)>c(OH-) 。
考点:考查盖斯定律、外界条件对平衡状态的影响、平衡常数计算以及浓度大小比较
本题难度:困难
3、实验题 20.(10分)某厂以重晶石(有效成分是BaSO4)为主要原料制取Ba(OH)2·8H2O晶体的示意图如下:
已知:i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) ΔH1=+226.2 kJ/mol
C(s)+CO2(g)=2CO(g) ΔH2=+172.5kJ/mol
ii.某些物质的溶解度(g/100g)简表
| | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| Ba(OH)2·8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |


参考答案:(1)+571.2
(2)途径1:① CO32-+Ba2+ =BaCO3↓; ② BaO+9H2O=Ba(OH)2·8H2O
途径2:20℃或常温;20℃时4种物质中Ba(OH)2·8H2O溶解度最小
(3)BaS+CuO+9H2O=Ba(OH)2·8H2O+CuS;为减少过滤过程中Ba(OH)2·8H2O的损失
本题解析:(1)由于①BaSO4(s)+2C(s)=2CO2(g)+BaS(s) ΔH1=+226.2 kJ/mol
②C(s)+CO2(g)=2CO(g) ΔH2=+172.5kJ/mol
ΔH=①+2×②=226.2+2×172.5="571.2" kJ/mol
(2)①氯化钡溶液中加入碳酸钠固体,发生复分解反应,BaCl2+Na2CO3="Ba" CO3↓+ 2NaCl,则离子方程式为CO32-+Ba2+ =BaCO3↓;②BaCO3经灼烧后生成BaO,氧化钡溶于水生成氢氧化钡,化学反应方程式为BaO+9H2O=Ba(OH)2·8H2O;途径2中的“操作”是加热浓缩,冷却结晶,过滤。依据上述溶解度简表分析,过滤时的最佳温度是20℃左右,因为当温度升高后,氢氧化钡晶体的溶解度会逐渐增大;能从混合液中得到Ba(OH)2·8H2O晶体的原因是在20℃时4种物质中Ba(OH)2·8H2O溶解度最小,温度在20℃时氢氧化钡晶体以沉淀的形式析出;
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2·8H2O晶体和CuS的浊液,反应化学方程式是BaS+CuO+9H2O=Ba(OH)2·8H2O+CuS;将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2·8H2O晶体,操作中趁热过滤是为减少过滤过程中Ba(OH)2·8H2O的损失
考点:热化学方程式的计算、离子方程式的书写、工艺流程
点评:本题考查内容较丰富,注意离子方程式及化学方程式的书写,本题的关键是弄明白反应的流程。
本题难度:困难
4、填空题 (8分)甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:③2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g)=2CO2(g) 的反应热
ΔH=______(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、 减小、不变)。负极的电极反应式为_______ ____。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;阳极泥为:
参考答案:(1)2△H1-2△H2+△H3; (2)>;<;
(3)减小 CH3OH-6e-+8OH-=CO32-+6H2O(4)粗铜,精铜,Ag、Au
本题解析:(1)①×2-②×2+③,整理可得2CO(g)+O2(g)=2CO2(g) ΔH=2△H1-2△H2+△H3;(20由于升高温度,CH4的平衡转化率增大。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,所以正反应方向是吸热反应,ΔH4>0;增大压强,平衡逆向移动,CH4的平衡转化率降低。根据图示可知P1<P2(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作原理是2CH3OH+3O2+4KOH=2K2CO3+6H2O,可见工作一段时间后,溶液的pH减小。负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是粗铜,阴极材料是精铜;在阳极上Cu及活动性比Cu强的金属Fe等失去电子,变为金属阳离子进入溶液,而活动性比Cu弱的金属Ag、Au等就沉淀在阳极底层,俗称阳极泥,所以阳极泥为Ag、Au。
考点:考查盖斯定律的应用、温度、压强对物质转化率的影响、燃料电池的各种原理及电镀的知识。
本题难度:困难
5、选择题 下列说法或表示方法正确的是
[? ]
A.由C(石墨)=?C(金刚石)?△H?=?+1.90?kJ·mol-1?可知金刚石比石墨稳定
B.在稀溶液中,H+(aq)+?OH-(aq)=?H2O(l)?△H?=-57.3?kJ·mol-1,若将含0.5?mol?
H2SO4的浓硫酸与含1?mol?NaOH的溶液混合,放出的热大于57.3?kJ
C.甲烷的标准燃烧热为△H?=-890kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H?=?-890?kJ·mol-1
D.已知:H2(g)+F2(g)?=?2HF(g);△H=?-270?kJ·mol-1,则1?mol氢气与1?mol氟气反应生成2?mol液态氟化氢放出的热量小于270?kJ
参考答案:B
本题解析:
本题难度:一般