时间:2025-06-26 01:40:21
1、选择题 通常人们把拆开某化学键所吸收的能量看成该化学键的键能,键能的大小可用于估算化学反应的 反应热△H(化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之 和的差)。一些化学键的键能数据如下。 下列热化学方程式正确的是

[? ]
 NH3 (g) △H=-421.9 kJ·mol-1
NH3 (g) △H=-421.9 kJ·mol-1  2NH3 (g) △H = -620. 8 kJ·mol-1
2NH3 (g) △H = -620. 8 kJ·mol-1  1/2N2(g)+3/2H2(g) △H = +45.4 kJ·mol-1
1/2N2(g)+3/2H2(g) △H = +45.4 kJ·mol-1  2NH3( g) △H=-45.4 kJ·mol-1
2NH3( g) △H=-45.4 kJ·mol-1参考答案:C
本题解析:
本题难度:一般
2、选择题 已知:H2(g)+F2(g)→2HF(g)+270kJ,下列说法正确的是
[? ]
A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量
参考答案:C
本题解析:
本题难度:简单
3、填空题 已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,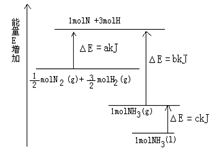
(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2)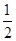 N2(g)+
N2(g)+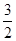 H2(g)
H2(g)  NH3(g ) △H= ;
NH3(g ) △H= ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
参考答案:(1)释放 (2)-( b - a) kJ·mol-1
(3)N2(g)+3H2(g)=2NH3 △H="-2(b+c" -a)kJ·mol-1
本题解析:(1)根据图像可知,1mol N 和3mol H 生成1mol NH3(g)是释放能量的。
(2)根据图像可知,反应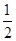 N2(g)+
N2(g)+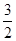 H2(g)
H2(g)  NH3(g )的△H=-( b-a) kJ/mol。
NH3(g )的△H=-( b-a) kJ/mol。
(3)根据图像可知,N2(g)和H2生成NH3(1)的热化学方程式为N2(g)+3H2(g)=2NH3 △H=-2(b+c -a)kJ·mol。
考点:考查反应热的判断、计算以及热化学方程式的书写
点评:该题是基础性试题饿考查,难度不大。该题的关键是明确反应热的计算依据,然后结合图像灵活运用即可。
本题难度:一般
4、填空题 (共7分)工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;请回答下列问题:
CH3OH(g)。图1表示反应中的能量变化;请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H = 。
CH3OH(g)的△H = 。
(2)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH =-193kJ/mol,又知H2O(l)= H2O(g) ΔH =+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
参考答案:(1)b —91KJ/mol
(2)CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol
本题解析:(1) 催化剂降低反应的活化能,所以b使用了催化剂;△H =生成物的总能量—反应物的总能量="—91" kJ/mol;(2) ①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH =-193kJ/mol,②H2O(l)= H2O(g) ΔH =+44 kJ/mol,根据盖斯定律,①-②×2得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol。
考点:本题考查反应热。
本题难度:一般
5、选择题 在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为A,破坏1molO=O键消耗的能量为B,形成1molC=O键释放的能量为C。则下列关系正确的是
A.2A+B>2C B.2A+B>4C C.2A + B < 2C D.2A + B < 4C
参考答案:D
本题解析:反应热就是断键形成的能量和形成化学键所放出的能量的差值,CO燃烧是放热反应,则根据方程式2CO+O2=2CO2和物质的结构式可知,一定有2A+B<4C,答案选D。
考点:考查反应热的计算
点评:该题是基础性试题的考查,主要是考查学生对反应热与化学键键能关系的熟悉了解程度,有利于培养学生的逻辑思维能力和抽象思维能力。明确化学键键能与反应热的关系是答题的关键。
本题难度:一般