时间:2025-06-26 01:33:46
1、选择题 有些物质的制备从化学性质的“强制弱”来看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是
A.NaBr(s)+H3PO4(浓)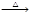 NaH2PO4(aq)+ HBr(g)
NaH2PO4(aq)+ HBr(g)
B.6CaO(l)+2Al(l)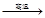 3CaO?Al2O3(s) +3Ca(g)
3CaO?Al2O3(s) +3Ca(g)
C.CaCO3(s) +2HCl(aq) →CaCl2(aq) +H2O (l) +CO2(g)
D.KICl2(aq)+H2S(aq)→KI (aq)+2HCl (aq) +S(s)
参考答案:AB
本题解析:A.物质的酸性HBr> H3PO4,所以从化学性质的“强制弱”来看NaBr(s)+H3PO4(浓) NaH2PO4(aq)+ HBr(g)难以进行,但是由于HBr容易挥发,而H3PO4是高沸点难挥发的酸,当HBr脱离平衡体系后,减小生成物的浓度平衡正向移动,H3PO4逐渐转化为HBr,正确;B.元素的金属性Ca>Al,所以从活动性强的制取活动性弱的来看,6CaO(l)+2Al(l)
NaH2PO4(aq)+ HBr(g)难以进行,但是由于HBr容易挥发,而H3PO4是高沸点难挥发的酸,当HBr脱离平衡体系后,减小生成物的浓度平衡正向移动,H3PO4逐渐转化为HBr,正确;B.元素的金属性Ca>Al,所以从活动性强的制取活动性弱的来看,6CaO(l)+2Al(l) 3CaO?Al2O3(s) +3Ca(g)不能进行,但是由于Ca的沸点低,Al的沸点高,当产生的Ca变为蒸汽从平衡体系中脱离后,更多的Al发生反应制取得到了Ca,正确;C.由于酸性HCl>H2CO3,所以CaCO3(s) +2HCl(aq) =CaCl2(aq) +H2O (l) +CO2(g) 从化学性质的“强制弱”来看可以发生,错误;D.由于还原性: H2S >IH,所以反应KICl2(aq)+H2S(aq)=KI (aq)+2HCl (aq) +S(s)可以发生,错误。
3CaO?Al2O3(s) +3Ca(g)不能进行,但是由于Ca的沸点低,Al的沸点高,当产生的Ca变为蒸汽从平衡体系中脱离后,更多的Al发生反应制取得到了Ca,正确;C.由于酸性HCl>H2CO3,所以CaCO3(s) +2HCl(aq) =CaCl2(aq) +H2O (l) +CO2(g) 从化学性质的“强制弱”来看可以发生,错误;D.由于还原性: H2S >IH,所以反应KICl2(aq)+H2S(aq)=KI (aq)+2HCl (aq) +S(s)可以发生,错误。
考点:考查勒夏特列原理在物质制取中的应用的知识。
本题难度:一般
2、选择题 一定条件下,反应2NO2(g)?2NO(g)+O2(g),下列哪一种状态可能没有达到化学反应限度( )
A.速率比:V(NO2):V(NO):V(O2)=2:2:l时的状态
B.混合气体的平均相对分子质量保持不变时的状态
C.生成NO2的速率与生成O2的速率比等于2:l时的状态
D.体系中的颜色保持不变时的状态
参考答案:A.V(NO2):V(NO):V(O2)=2:2:l说明了反应中各物质的转化量的关系,不能说明该反应达到平衡状态,故A符合;
B.该反应是一个反应前后气体的物质的量增大的反应,当混合气体的平均相对分子质量保持不变时的状态时,该反应达到平衡状态,故B不符合;
C.当生成NO2的速率与生成O2的速率比等于2:l时的状态时,该反应达到平衡状态,故C不符合;
D.二氧化氮是红棕色气体,一氧化氮和氧气无色,当反应达到平衡状态时,二氧化氮的浓度不变,则体系中混合气体颜色不变,所以能说明该反应达到平衡状态,故D不符合;
故选A.
本题解析:
本题难度:一般
3、填空题 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: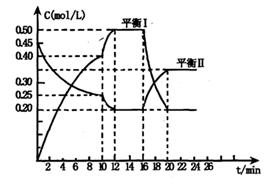
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=?;
(2)根据图示可确定x:y=?;
(3)0~l0min容器内压强____?(填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是?;第16min引起曲线变化的反应条件可能是____?;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1?K2(填“>”“=”或“<”)
参考答案:(10分)(1)0.02mol/(L·min)(2分)?(2)1∶2(2分)?(3)变大(1分)
(4)④⑥(2分)?④(1分)?(5)>? (2分)
本题解析:(1)v(A)=(0.45mol/L-0.25mol/L)÷10min=0.02mol/(L·min)。
(2)根据图像分析及物质反应的物质的量之比等于化学计量数之比得知,x:y=1:2。
(3)根据(2)得知,正反应方向是体积增大的,故压强变大。
(4)l0min后化学反应速率加快了直到到达化学平衡状态,反应条件可能为升温和加催化剂,故选④⑥。16min后是化学平衡逆向移动,结合正反应是放热反应,故反应条件可能是升温,故选④。
(5)化学平衡常数等于生成物的幂之积除以反应物的幂之积,经过计算得K1>K2。
点评:本题考查反应速率、平衡常数计算、平衡移动等,难度中等,考查学生对基础知识的掌握程度。
本题难度:一般
4、选择题 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,有反应: CH4(g)+2NO2(g)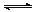 N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol测得n(N2)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol测得n(N2)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.25 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | …… | 0.30 | 0.30 |
参考答案:D
本题解析:A、0~10min内,T1时V(N2)的平均反应速率为0.20/10=0.02mol/(L
本题难度:一般
5、选择题 碘钨灯比白炽灯使用寿命长.灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g) WI2(g),△H<0(温度T1<T2).下列说法正确的是( )
WI2(g),△H<0(温度T1<T2).下列说法正确的是( )
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式
D.利用该反应原理可以提纯钨
参考答案:AD
本题解析:
本题难度:简单