时间:2025-06-26 01:32:58
1、选择题 将过量的CO2分别通入①Na2SiO3溶液;?②CaCl2溶液?③Ca(ClO)2溶液?④饱和Na2CO3?溶液,最终溶液中有白色沉淀析出得是( )
A.①②③④
B.①④
C.①②③
D.②③
参考答案:B
本题解析:
本题难度:简单
2、简答题 宝石是一种贵重的首饰,石榴子石常用来制造宝石.常见的石榴子石有镁铝石榴子石(Mg3Al2Si3O12)、钙铝石榴子石(Ca3Al2Si3O12)等.请回答:
(1)用氧化物的形式表示钙铝石榴子石(Ca3Al2Si3O12):______.
(2)从物质的分类来看,石榴子石属于硅酸盐,下列物质主要成分是硅酸盐的是______.
A.光导纤维B.水玻璃C.芯片 D.大理石.
参考答案:;(1)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO?nSiO2?mH2O),
所以用氧化物的形式表示钙铝石榴子石(Ca3Al2Si3O12)为:3CaO?Al2O3?3SiO2;
故答案为:3CaO?Al2O3?3SiO2;
(2)水玻璃的主要成分是硅酸钠,属于硅酸盐,光导纤维的主要成分是二氧化硅,芯片的主要成分是单质硅,大理石的主要成分是碳酸钙;
故答案为:B.
本题解析:
本题难度:一般
3、选择题 工业制造一般的光学玻璃用到的原料是( )
A.石灰石、纯碱、粘土、硼砂
B.氧化铅、纯碱、石灰石、石英
C.纯碱、粘土、石英、氯化钴
D.硼砂、烧碱、氧化亚铜、石英砂
参考答案:B
本题解析:
本题难度:简单
4、填空题 (6分)写出下列过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________
②电解法冶炼铝____________________________________________
③ NaH溶于水产生H2?_______________________________________
参考答案:(6分)(各2分)
① Fe2O3 + 2Al?高温??2Fe + Al2O3
② 2Al2O3(熔融)电解??4Al + 3O2↑
③? NaH + H2O =" NaOH" + H2↑
本题解析:略
本题难度:简单
5、填空题 钛合金是航天航空工业的重要材料。由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)制备Ti等产品的一种工艺流程示意图如下:
已知:① TiO2+易水解,只能存在于强酸性溶液中。 ②常温下,难溶电解质溶解度与pH关系图。
③25 ℃时TiO(OH)2溶度积Ksp=1×10-29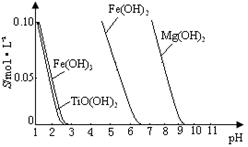
回答下列问题:
(1)写出钛铁矿酸浸时,反应的离子方程式?。
(2)操作Ⅱ包含的具体操作方法有?。
(3)向“富含TiO2+溶液”中加入Na2CO3粉末的作用是?, TiO2+水解的离子方程式为?,当溶液pH= ?时,TiO(OH)2已沉淀完全。
(4)加入铁屑将Fe3+转化为Fe2+的原因是?。
参考答案:(1)FeTiO3+4H+ = TiO2++Fe2++2H2O
(2)蒸发浓缩,冷却结晶,过滤
(3)调节溶液pH,促进TiO2+水解? TiO2++2H2O TiO(OH)2+2H+?2
TiO(OH)2+2H+?2
(4)避免使Fe3+和TiO2+共沉淀。
本题解析:(1)钛铁矿酸浸时,发生反应的化学方程式为FeTiO3+2H2SO4= TiOSO4+FeSO4+2H2O,其相应的离子方程式FeTiO3+4H+ = TiO2++Fe2++2H2O。(2)向含有TiO2+、Fe2+、Fe3+等的酸性溶液中加入适量的Fe粉,发生反应:2Fe3++Fe=3Fe2+.然后将溶液蒸发浓缩、冷却结晶就会产生FeSO4·7H2O.然后将晶体过滤出来。就得到了绿矾。旅游热中含有大量的TiO2+离子,向该溶液中加入Na2CO3粉末,调整溶液的酸碱性,促进TiO2+水解,发生反应TiO2++2H2O TiO(OH)2+2H+。由图像可知当溶液的PH=2时TiO(OH)2已沉淀完全。(4)若不加入Fe粉,就会同时产生TiO(OH)2和Fe(OH)3.导致制取的物质纯度不高。所以加入铁屑将Fe3+转化为Fe2+避免使Fe3+和TiO2+共沉淀。
TiO(OH)2+2H+。由图像可知当溶液的PH=2时TiO(OH)2已沉淀完全。(4)若不加入Fe粉,就会同时产生TiO(OH)2和Fe(OH)3.导致制取的物质纯度不高。所以加入铁屑将Fe3+转化为Fe2+避免使Fe3+和TiO2+共沉淀。
本题难度:一般