时间:2025-06-26 01:32:58
1、选择题 从海水中提取下列物质,可以不涉及化学变化的是
A.Mg
B.K
C.NaCl
D.Br2
2、填空题 (8分)2004年10月1日,南昌八一广场以全新的面貌重新向市民开放,成为南昌的一大亮点。在这次改造扩建的过程中采用了大量的花岗石(不与常见酸反应)和大理石。要区别这两种石料,正确的操作是________________________________________________。
3、填空题 (12分)
某炼铁废渣中含有大量CuS及少量铁的化合物(铁元素的化合价为+2和+3价),工业上以该废渣为原料生产CuCl2的工艺流程如下: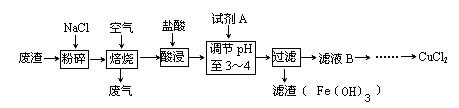
焙烧过程中发生的主要反应为:CuS+2NaCl+2O2高温CuCl2+Na2SO4。
回答下列问题:
(1)焙烧前先进行粉碎的理由是_____________________________________________。
(2)试剂A应选用 ? (填编号)①NaClO、②Cl2、③H2O2溶液、④浓硫酸
加入试剂A的目的是____________________________________________________________。
(3)上述过滤操作中需要用到的玻璃仪器有_____________________________________________。
(4)从CuCl2溶液得到CuCl2晶体的操作是?(写出操作名称),该操作必需在HCl气流中进行,原因是_____________________________________________(用离子方程式表示)。
(5)如何检验滤液B中是否还有未沉淀的Fe3+______________________________,
加试剂A调节溶液pH=4时,c(Fe3+)为_______________。(已知Ksp[Fe(OH)3]=2.6×10-39)
4、选择题 为了解决目前存在的世界性能源危机,新的替代能源主要包括
①核能?②柴草?③焦碳?④太阳能?⑤氢能?⑥液化石油气?⑦水煤气?⑧天然气
A.②③⑥⑦
B.①④⑤
C.③⑥⑦⑧
D.①②④
5、选择题 空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下,其中不正确的是( )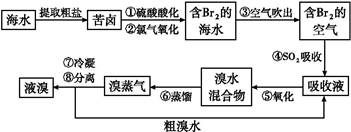
A.步骤①中用硫酸酸化可防止Cl2、Br2与水反应
B步骤④的离子方程式Br2+SO2+H2O 2H++2Br-+S
2H++2Br-+S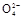
C溴在周期表中位于4周期ⅦA族。
D.步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗