时间:2025-06-26 01:25:39
1、推断题 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY,X、Y均为元素周期表前20号元素,其阳离子和阴离子分别是10电子和18电子的单核粒子,且1 mol XY含有28 mol电子。
(1)该融雪剂的化学式是___;X与氢元素形成的化合物的电子式是___。
(2)元素D、E原子的最外层电子数是其电子层数的2 倍,D与Y相邻,则D所在同主族元素的氢化物中,沸点最低的是__(化学式);E的原子结构示意图是________。
参考答案:(1)NaCl ;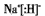
(2)H2S? ;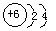
本题解析:
本题难度:一般
2、选择题 假设x是ⅡB族中元素的原子序数,?那么原子序数为x+1的元素是
A.ⅠB族
B.ⅢB族
C.ⅢA族
D.ⅡA族
参考答案:C
本题解析:
本题难度:简单
3、简答题 Al和Ga及N和As分别是同主族的元素,请回答下列问题:
(1)砷化镓是一种半导体材料,其化学式为______.
(2)写出As原子处于基态时的核外电子排布式______.
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与______个氮原子相连,氮化铝晶体属于______晶体.
(4)NH3是氮的氢化物,中心原子的杂化方式是______,存在化学键的类型是______,NH3的沸点比AsH3高的原因是______.
参考答案:(1)砷元素位于第ⅤA族,所以最低负价是-3价,镓元素元素处于第ⅢA族,最高正价是+3价,根据化合价规则,所以砷化镓的化学式为:GaAs,故答案为:GaAs;
(2)根据基态电子排布规律,As原子的基态电子排布式为:1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(3)氮化铝晶体与金刚石类似,均是正四面体结构,每个铝原子与4个氮原子相连,是由原子构成的原子晶体,故答案为:4;原子;
(4)氨气是空间三角锥形结构,氮原子以sp3杂化成键,形成空间三角锥形结构,氮原子和氢原子间是共价键,在氨气分子中,存在氢键,所以导致沸点高于同主族的其他氢化物,故答案为:sp3;共价键;氨气分子间有氢键.
本题解析:
本题难度:一般
4、选择题 对于卤族元素的叙述中不正确的是( )
A.沸点HF>HCl>HBr>HI
B.还原性HI>HBr>HCl>HF
C.热稳定性HF>HCl>HBr>HI
D.氧化性F2>Cl2>Br2>I2
参考答案:A、因氢化物的相对分子质量越大,沸点越大,但HF分子中有氢键,沸点最大,则沸点HF>HI>HBr>HCl,故A错误;
B、因非金属性F>Cl>Br>I,则还原性HI>HBr>HCl>HF,故B正确;
C、因非金属性F>Cl>Br>I,则热稳定性HF>HCl>HBr>HI,故C正确;
D、因非金属性F>Cl>Br>I,则氧化性F2>Cl2>Br2>I2,故D正确;
故选A.
本题解析:
本题难度:一般
5、选择题 二种短周期元素组成的化合物中,原子个数比为1:3,若二种元素的原子序数分别为a和b,则a、b的关系可能是
[? ]
参考答案:D
本题解析:
本题难度:简单