时间:2025-06-26 01:20:45
1、选择题 如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是
A.根据质量守恒定律可推知,1个Z分子中含有2个A原子
B.该反应属于分解反应
C.该反应属于氧化还原反应
D.X、Y、Z三种物 质均属于非电解质
质均属于非电解质
2、简答题 把6.5g?锌粉放入足量的盐酸中,锌完全反应.试计算:
(1)6.5g锌的物质的量______;
(2)参加反应的氯化氢的物质的量______;
(3)生成氢气的体积(标准状况)______.
3、推断题 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: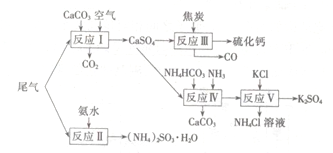
(1)反应III中氧化剂与还原剂的物质的量之比为 。
(2)反应Ⅳ的化学方程式为 。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为 。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下: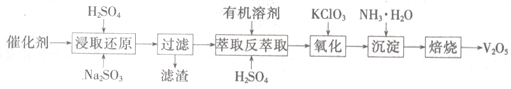
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____ 的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为 。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为 。
4、选择题 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是:(? )?
A.CO2的电子式:
B.质量数为37的氯原子:1737Cl
C.NH4Cl的电子式:
D.原子核内有10个中子的氧原子:
5、选择题 代硫酸钠可用作脱氯剂,已知25.0 mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-时,S2O32-转化成( )
A.S2-
B.S
C.SO32-
D.SO42-