时间:2025-06-26 01:20:45
1、选择题 在5ml0.05mol/L的某金属氯化物的溶液中,滴加
0.1mol/LAgNO3溶液,生成沉淀的质量与加入AgNO3溶液的体积关系如图所示,则该氯化物中金属元素的化合价为
A.+1
B.+2
C.+3
D.+4
参考答案:C
本题解析:
分析:根据氯离子和银离子之间反应生成氯化银沉淀的实质以及氯化物的化学式进行计算.
解答:解:氯化物种的Cl-和Ag+1:1反应,因此消耗掉的硝酸银的物质的量为这些溶液中Cl-离子的物质的量,n(Cl-)=n(Ag+)=7.5×10-3L×0.1mol/L=7.5×10-4mol.
设该金属的化合价为X其化学式为A(Cl)x,n(Ax+)=5×10-3L×0.05mol/L= ,解得x=3.
,解得x=3.
故选C.
点评:本题考查学生分析和解决问题的能力,是一道有关离子反应的计算题,难度不大.
本题难度:简单
2、选择题 人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可用左下图表示。右下图为离子反应、氧化还原反应和置换反应三者之间的关系,则C表示 
A.离子反应
B.氧化还原反应
C.置换反应
D.三者都可以
参考答案:A
本题解析:置换反应一定有化合价的升降,一定属于氧化还原反应,故B代表置换反应,而A代表氧化还原反应,进而可知C为离子反应,与前两者均有交叉。故选A
本题难度:简单
3、选择题 用硫酸酸化的三氧化铬(CrO3)遇酒精后,其颜色由红色变为蓝绿色(反应如下),用此反应可测得司机是否是酒后驾车。此反应的氧化剂是(? )
2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O
A.H2SO4
B.CrO3
C.Cr2(SO4)3
D.C2H5OH
参考答案:B
本题解析:通过分析题中氧化还原反应方程式,可知CrO3中Cr元素的化合价从+6降到+3,可知其是氧化剂。
本题难度:简单
4、简答题 镁和铝的合金5.1g恰好完全溶于98g的稀硫酸中,充分反应后得到标况下的氢气5.6L,求(1)合金中铝的质量?(2)稀硫酸的溶质质量分数.
参考答案:(1)镁和铝的合金5.1g恰好完全溶于98g的稀硫酸中,
标况下的氢气的物质的量为5.6L22.4L/mol=0.25mol,
设Mg的物质的量为x,Al的物质的量为y,则
根据电子守恒及质量关系可知,
本题解析:
本题难度:一般
5、选择题 下列化学用语正确的是
A.HCN分子的结构式:H-C≡N
B.乙烯的结构简式:CH2CH2
C.F-离子结构示意图: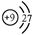
D.二氧化碳的电子式: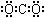
参考答案:A
本题解析:本题考查化学用语,属于容易题。B项乙烯的碳碳双键不可以省略;C项,F-离子最外层应为8个电子;D项,CO2中的C就是8电子稳定结构。
本题难度:一般