时间:2025-06-26 01:09:15
1、填空题 燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:?
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的?(填“正极”或“负极”),另一个电极上的电极反应式为:?
③随着电池不断放电,电解质溶液的碱性?(填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率?(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变)。
参考答案:(11分)(1)①CH4+O2 CO2+2H2O (2分) ;?
CO2+2H2O (2分) ;?
②负极 (1分);? 2O2+4H2O+8e-==8OH- (2分)
③减小 (1分) ;?④大于(1分)
(2)①2CH3OH+3O2+4OH-=2CO32-+6H2O?(2分);?
②负 (1分);?下降(1分)
本题解析:(1)①甲烷与氧气反应生成二氧化钛和水,故方程式为CH4+O2 CO2+2H2O。
CO2+2H2O。
②CH4失去电子,发生氧化反应,是负极,O2是正极,得到电子,发生还原反应,电极反应式为2O2+4H2O+8e-==8OH-。
③根据反应式可知,KOH发生反应,故电解质溶液的碱性减小。
④甲烷燃烧会浪费大量的能量,故甲烷燃料电池的能量利用率大于甲烷燃烧的能量利用率。
(2)①根据题中给出的反应物和生成物,该电池反应的总离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O。
②甲醇失去电子,化学价升高,发生氧化反应,故甲醇在负极发生反应。强碱参与了反应,故电池在放电过程中溶液的pH将降低。
点评:本题考查的是燃料电池和新型电源的相关知识,题目难度大,熟悉原电池的工作原理是解题的关键,注意基础知识的学习、掌握及应用。
本题难度:一般
2、填空题 (14分)铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:?
Pb+PbO2+4H++2SO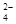
 2PbSO4+2H2O
2PbSO4+2H2O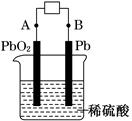
请回答下列问题(不考虑氢、氧的氧化还原):?
(1) 该蓄电池放电工作时的负极材料是?,用其电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加?g。
充电时,上图中A极应接直流电源的?(填“正极”或“负极”)。充电时A极的电极反应式是?;
(2) MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式 ? 。现以铅蓄电池为电源电解,当蓄电池中有0.4mol H+被消耗时,则电路中通过的电子的物质的量为?,MnO2的理论产量为 ? g。
参考答案:(1)铅?48,?正 ?PbSO4+2H2O-2e-= PbO2+4H++SO42-?(2)2H++2e-=H2?0.2mol? 8.7
本题解析:(1)根据电池的总反应可知,铅蓄电池放电时的负极发生氧化反应,所以负极材料为Pb,发生的电极反应为Pb-2e-+SO42-=PbSO4,因此负极增加的质量为SO42-的质量,用该电池电解氯化钠溶液时,当阳极上收集11.2L氯气时,转移1mol电子,所以负极增加48g。充电时,A极应发生氧化反应,所以与电源正极相连,电极反应为PbSO4+2H2O-2e-= PbO2+4H++SO42-。
(2)电解酸化的MnSO4溶液,阴极发生还原反应,电极反应为2H++2e-=H2。根据铅蓄电池的总反应可知,1molH2SO4参加反应转移1mol电子,所以0.4mol H+被消耗时,转移0.2mol 电子,生成MnO20.1mol,质量为8.7g。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:一般
3、选择题 下列叙述正确的是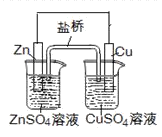
A.电镀时,通常把待镀的金属制品作阳极
B.上图Zn为负极,发生还原反应
C.上图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液
D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O
参考答案:D
本题解析:A.电镀时,通常把待镀的金属制品作阴极,错误;B.由于金属活动性Zn>Cu,所以Zn为负极,发生氧化反应,错误;C.右图电子由Zn电极流向Cu电极,盐桥中的Cl-移向正电荷较多的ZnSO4溶液,错误;D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O,正确。
考点:考查原电池、电解池的反应原理及应用的知识。
本题难度:一般
4、选择题 下列说法正确的是(?)
A.碱性锌锰干电池是二次电池
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质没有储存在电池内部
参考答案:CD
本题解析:依据一次电池、二次电池及燃料电池的有关知识可得答案。
本题难度:一般
5、选择题 下列关于碱性锌锰电池的判断正确的是 ( )
A.Zn是正极, MnO2是负极
B.工作时电子由MnO2经外电路流向Zn
C.Zn是负极, MnO2是正极
D.Zn 电极发生还原反应,MnO2电极发生氧化反应
参考答案:C
本题解析:A、活泼金属做负极,故锌为负极;
B、电子从负极流向正极,故从Zn流向MnO2;
C、正确
D、锌负极发生氧化反应。
本题难度:一般