时间:2025-06-26 01:01:07
1、推断题 A和B是两种盐,其焰色反应皆为紫色(透过蓝色钴玻璃观察).有关实验及现象如下: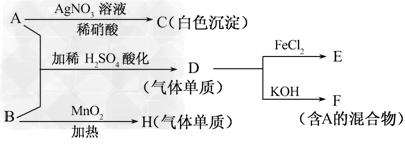
请回答:
(1)写出A、B的化学式________、________.
(2)写出D与FeCl2溶液反应的化学方程式__________________________.
(3)写出A、B反应生成D的离子方程式__________________________________.
(4)H的一种同素异形体的化学式为________.
2、简答题 A、B、C三种化合物,都是由氢、氮、氧三种元素所组成,其中一种是弱电解质,余均是强电解质.A和B可以通过复分解反应形成C.常温,浓度均为amol?L-1的A、B、C三种稀溶液中,pH大小关系是pH(B)>pH(C)>pH(A).
(1)写出物质的化学式:A:______B:______C:______.
(2)A、B、C三种物质各自溶解在水中时,能使水的电离程度增大的是______,对应的离子方程式为:______.
(3)若将a?mol?L-1的B溶液进行下列实验,将变化填写在对应表格中
| 项目 | 溶液中c(H+) | 溶液中c(OH-) | 对B电离的影响 取1mL用蒸馏水稀释为100mL溶液 取1mL用同浓度的C溶液稀释为100mL溶液 3、填空题 (9分)现有A、B、C三种均含同一种元素的无机物,它们之间的转化关系如下图所示(部分产物已略去): 4、选择题 已 5、选择题 (15分)现有A、B、C、D、E、F六种中学常见的元素,其原子序数依次增大。①D的一种含氧酸根离子与H+结合生成D的单质、D的氧化物和水;该D的氧化物通入品红溶液,溶液褪色,加热溶液又变红色;②在短周期元素中,只有C的氧化物和烧碱反应生成的溶液与过量盐酸混合产生白色沉淀;③A与D的原子最外层电子数相同;④B的单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑤E有多种含氧酸,其氧化性与“同元素价态越高,其氧化性越强”一般规律相悖,它是生活调味品和农药的组成元素 ⑥E单质+F单质 |