时间:2025-06-26 00:55:23
1、实验题 实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口。静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:__________________________________。
(2)采用水浴加热的原因是__________________________________________________。
(3)反应时铁屑过量的目的是(用离子方程式表示)____________________________。
(4)溶液趁热过滤的原因是__________________________________________________。
(5)塞紧试管口的目的是____________________________________________________。
(6)静置冷却一段时间后,在试管中观察到的现象是____________________________。
参考答案:(1)Fe + H2SO4=FeSO4 +H2↑(2)水浴加热受热均匀,温度容易控制。
(3)Fe+2Fe3+=3Fe2+(4)溶液趁热过滤的目的是减少FeSO4的损失;
(5)防止空气中的氧气将FeSO4氧化。(6)有浅绿色硫酸亚铁晶体析出
本题解析:(1)铁是活泼的金属和稀硫酸反应生成硫酸亚铁,反应的化学方程式是Fe + H2SO4=FeSO4 +H2↑。
(2)采用水浴加热能使溶液受热均匀,且温度容易控制。
(3)硫酸亚铁易被氧化生成硫酸铁,所以反应时铁屑过量的目的是防止硫酸亚铁被氧化,反应的离子方程式是Fe+2Fe3+=3Fe2+。
(4)因为一般物质的溶解度随温度的升高而增大,所以溶液趁热过滤的目的是减少FeSO4的损失。
(5)由于硫酸亚铁易被氧化生成硫酸铁,所以塞紧试管口的目的是防止空气中的氧气将FeSO4氧化。
(6)硫酸亚铁晶体是显浅绿色的,所以一段时间后在试管中观察到的现象是有浅绿色硫酸亚铁晶体析出。
点评:该题是高考中的常见题型,属于中等难度的试题。试题通过硫酸亚铁的制备,重点考查学生对实验原理、实验设计以及实验操作能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。该题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
2、实验题 高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见上图) 加入一定量MnO2和水,搅拌,通人SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+ H2SO3= MnSO4 +H2O)。
①石灰乳参与反应的化学方程式为__________________________________
② 反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有_______________________________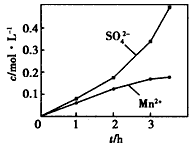
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如上图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异的原因是_________________________
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH= 7.7。请补充由(1) 制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①_______________________________________;
②_______________________________________;
③________________________________________;
④_______________________________________;
⑤低于100℃干燥。
参考答案:(1)①Ca(OH)2十SO2=CaSO3+H2O;?②控制适当的温度、缓慢通人混合气体;③Mn2+催化O2与H2SO3反应生成H2SO4?
?(2)①边搅拌边加入NaHCO3(或Na2CO3),并控制溶液pH<?7.7;②过滤,用少量水洗涤2—3次;③检验SO42-是否被洗涤除去;?④用少量C2H5OH洗涤
本题解析:
本题难度:一般
3、选择题 向某溶液中加入稀HNO3酸化的BaCl2溶液,有白色沉淀产生。该溶液含有
A.CO32―
B.OH―
C.SO42―
D.HCO3―
参考答案:C
本题解析:向某溶液中加入稀HNO3酸化的BaCl2溶液,有白色沉淀产生,则该溶液中一定含有SO42―,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该类试题学生需要明确的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单
4、填空题 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)实验室进行过滤操作的常用玻璃仪器有?。
(2)反应器I中的温度最佳为?(填序号);操作②的名称为?。
A. 0°C ;? B. 20°C ;? C. 80°C ;? D. 120°C?
(3)反应器II中发生反应的离子方程式为?。
(4)加快反应器II中反应速率的措施有?(写出一种措施即可)等。从反应器II中获得NaClO2?粗品的实验操作依次是?(填序号,下同),进一步提纯的操作名称为?。
A.过滤? B.重结晶? C.蒸馏? D.蒸发浓缩? E.蒸干灼烧? F.冷却结晶? G.萃取分液
(5)上述流程中可循环使用的物质为?,副产品除NaClO2、NaHSO4外还有?(填化学式)。
参考答案:(1)(普通)漏斗、玻璃棒、烧杯(3分,各1分)
(2)C; 蒸馏 (各1分)
(3)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O?(2分)
(4)适当升高温度(增大NaOH溶液的浓度、增大气体(SO2、ClO2)和NaOH溶液的接触面积等)(2分);DF(A)(2分);B(1分)
(5)硫酸;Na2SO4(各2分)
本题解析: (1)实验室常用的玻璃仪器有(普通)漏斗、玻璃棒、烧杯,做题的时候容易写不全,所以在作答时联想实验时的情境,从下往上想不容易出错。
(2)反应器I中加入的氯酸钠在浓硫酸的作用下发生了氧化还原反应,Cl化合价+4←+5→+7,因此得到的含氯化合物中有ClO2 气体和高氯酸,所以要得到较高浓度的高氯酸溶液,应该尽可能的升温使ClO2 气体溢出,同时温度不能过高,超过高氯酸沸点温度90°C容易使高氯酸气化,所以最佳温度应该选C,80°C。而在后一阶段的滤液中再获得纯净的高氯酸产品,可以选择蒸馏,升高温度至高氯酸沸点温度,蒸馏得到高氯酸纯品。
(3)从反应II的前后反应物和产物可以看出,Cl的化合价+4→+3,发生了氧化还原反应,ClO2 气体做氧化剂, SO2在反应中被氧化为了SO42-,有碱参与反应生成盐和水,所以根据氧化还原得失电子守恒进行缺项配平,可得反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O。(4)影响反化学应速率的因素有温度、浓度、接触面积等,所以在反应器II中要加快反应速率,可以通过适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积等措施来改变。若要从从反应器II中获得NaClO2 晶体粗品,可以通过蒸发浓缩、冷却结晶、过滤的方法得到,故选DFA;进一步提纯粗品晶体,则应该对该粗产品进行重结晶处理。
(5)上述流程分为2个生产方向,在生产高氯酸的环节中,蒸馏得到高氯酸纯品剩下的溶液为硫酸溶液,所以硫酸溶液可以循环到反应器I中加以利用;而在生产副产品NaClO2中还生成了有Na2SO4,所以副产品共有NaClO2、NaHSO4、Na2SO4 。
本题难度:一般
5、选择题 下列有关除杂的实验操作合理的是
[? ]
A.除去石英(主要成分为SiO2)中少量碳酸钙:用稀盐酸溶解后过滤
B.除去甲苯中混有的少量苯酚:加入浓溴水后过滤
C.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
D.除去乙酸乙酯中混有的少量乙酸、乙醇:加人饱和氢氧化钠溶液振荡、静置后分液
参考答案:A
本题解析:
本题难度:一般