时间:2025-06-26 00:47:12
1、选择题 下列用来表示物质变化的化学用语中,正确的是( )
A.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-=Fe2+
B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
参考答案:D
本题解析:钢铁发生电化学腐蚀时,铁作负极,失去电子,负极电极反应式是Fe-2e-=Fe2+,A不正确;在氢氧燃料电池中,氧气在正极通入,氢气在负极通入,B不正确;粗铜精炼时,与电源正极相连的是粗铜,选项C不正确;电解池中阳极失去电子,发生氧化反应,则电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑,D正确,答案选D。
点评:该题是基础性试题的考查,难度不大。明确原电池和电解池的工作原理是答题的关键,有利于培养学生的逻辑思维能力和应试能力,注意相关知识的积累和总结。
本题难度:一般
2、选择题 如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是(?)
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe →Fe2++2e-
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
参考答案:18.B
本题解析:根据装置可知,a和b中都是生铁的电化学腐蚀。其中a中发生的是吸氧腐蚀,压强降低;b中发生的是析氢腐蚀,生成氢气,压强增大,所以红墨水柱两边的液面变为左高右低,B不正确,其余选项都是正确的,答案选B。
本题难度:一般
3、选择题 下列叙述错误的是( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
参考答案:A.生铁中含有碳,碳、铁和电解质溶液构成原电池,铁作负极而易被腐蚀,所以生铁的抗腐蚀能力比纯铁弱,故A正确;
B.锡、铁和电解质溶液构成原电池,铁作负极而易被腐蚀,所以用锡焊接的铁质器件,焊接处易生锈,故B正确;
C.在铁制品上镀铜时,镀件铁制品为阴极,铜盐为电镀液,故C错误;
D.铁管上镶嵌锌块,锌、铁和电解质溶液构成原电池,铁作原电池正极而被保护,所以铁管不易被腐蚀,故D正确;
故选C.
本题解析:
本题难度:一般
4、简答题 某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: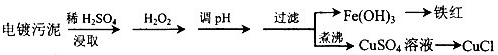
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 开始沉淀的pH 2.3 7.6 4.4 完全沉淀的pH 3.2 9.7 6.4 |
参考答案:(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物,双氧水有强氧化性,能氧化还原性的物质,Fe2+具有还原性,酸浸后加入H2O2,Fe2+能被双氧水氧化为高价离子,便于调整pH值与
Cu2+分离,调pH步骤中加入的试剂最好是加入某种物质除去溶液中的酸且不引进新的杂质,所以要加入氧化铜、或氢氧化铜、碳酸铜,当溶液的pH值4.4时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,所以要使三价铁离子和铜离子分离,过滤操作用到的仪器有铁架台、漏斗、烧杯、玻璃棒等;其中属于玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:将Fe2+氧化成Fe3+.便于调整pH值与Cu2+分离;CuO、或Cu(OH)2、或CuCO3;漏斗、烧杯、玻璃棒;
(2)过氧化氢性质比较稳定,若加热到153℃便猛烈的分解为水和氧气,将溶液中过量的H2O2除去可加热至沸避免影响下一步CuCl的生成,因为CuSO4中+2价的铜能把Na2SO3中+4价的硫氧化成+6价的硫,向CuSO4溶液中加入一定量的NaCl、Na2SO3时生成白色的CuCl沉淀,反应的化学方程式为:2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4,
故答案为:除净溶液中的H2O2,避免影响下一步CuCl的生成;2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4;
(3)设样品中CuCl的质量为x,有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则:
由化学反应方程式可知:CuCl~~~Fe2+~~~Ce4+
11
n(CuCl)24.60×10-3L×0.1000mol/L
所以n(CuCl)=24.60×10-3L×0.1000mol/L=2.46×10-3mol.
所以该样品CuCl的质量为2.46×10-3mol×99.5g/mol=0.2448g.
0.2500g合格的CuCl中含有CuCl的质量0.2500g×96.5%=0.2413g,小于0.2448g,所以该样品中CuCl的质量分数符合标准,
故答案为:符合;
(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,c(H+)=10-14c(OH-),反应
Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=c3(H+)c(Fe3+)═10-42c(Fe3+)?c3(OH-)=2.5×10-5,
故答案为:2.5×10-5.
本题解析:
本题难度:简单
5、计算题 某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
(1)写出甲中通入甲醇这一极的电极反应式?。
(2)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式?,原混合溶液中NaCl的物质的量浓度为??mol/L,CuSO4的物质的量浓度为??mol/L。(假设溶液体积不变)
(3)电解至t3时,消耗水的质量为??g。
参考答案:(1)CH3OH-6e-+8OH-=CO32-+6H2O(2分)
(2)4OH--4e-=O2↑+2H2O (2分)? 0.1(2分)? 0.1(2分)
(3)0.72 (2分)
本题解析:(1)甲图为甲醇燃料电池, 2CH3OH+3O2=2CO2+4H2O?①
CO2+2KOH=K2CO3+H2O?②
①+②×2,得:甲醇燃料电池的总化学反应为:2CH3OH+3O2+4KOH=6H2O+2K2CO3
总离子反应为:2CH3OH+3O2+4OH-=6H2O+2CO32-
(+):O2+2H2O+4e-=4OH-
(-)=总离子反应-(+)×3,得:2CH3OH+16OH--12e-=12H2O+2CO32-
化简,得:CH3OH - 6e-+ 8OH- = CO32-+ 6H2O
(2)乙图为电解池,铁片接甲图的负极,故铁片做电解池的阴极;
石墨棒接甲图的正极,故石墨棒做电解池的阳极;
溶液中阴离子(Cl-、OH-、SO42-)移向阳极,且放电顺序为:Cl->OH->SO42-,
电极反应为:先2Cl--2e-=Cl2↑,后4OH--4e-=O2↑+2H2O
阳离子(Cu2+、H+、Na+)移向阴极,且放电顺序为:Cu2+>H+>Na+,
电极反应为:先Cu2++2e-=Cu,后2H++2e-=H2↑
故丙图中,I线对应阴极(铁片)的反应,II线对应阳极(石墨棒)的反应;
分析丙图:到t1时,生成V(Cl2)=224ml,标准状况下n(Cl2)="0.01" mol,
2Cl--2e-=Cl2↑
2? 1
n(Cl-)? 0.01mol,则n(Cl-)= 0.02mol,C(NaCl)="0.02mol/0.2L=0.1" mol/L;
V(O2)="672ml-224ml=448" ml,标准状况下n(O2)="0.02" mol,故阳极失电子的物质的量为:
2Cl-- 2e- = Cl2↑? 4OH-- 4e- = O2↑+2H2O
2? 1? 4? 1
0.02mol? 0.01mol? 0.08mol 0.02mol
两极电子转移守恒(均为0.02mol+ 0.08mol=0.1mol),则阴极得电子的物质的量为:
V(H2)="672ml," 标准状况下n(H2)=0.03mol,
2H++ 2e- = H2↑?故? Cu2+ + 2e-?=Cu
2? 1? 1? 2
0.06mol 0.03mol? 0.02mol 0.04mol
C(CuSO4)="0.02mol/0.2L=0.1" mol/L;
(3)2H2O=2H2↑+O2↑
36g? 1mol
0.72g? 0.02mol
本题难度:一般