时间:2025-06-26 00:47:12
1、选择题 如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺?序是
A.4>2>1>3
B.2>1>3>4?
C.4>2>3>1
D.3>2>4>1
参考答案:A
本题解析:略
本题难度:简单
2、选择题 化学在生产和日常生活中有广泛的应用.下列说法不正确的是( )
A.向海水中加净水剂明矾可以使海水淡化
B.减少使用氟氯代烃的目的是为了保护臭氧层
C.大量使用含磷洗涤剂会造成水体的富营养化
D.镀层破损后,镀锡铁板比镀锌铁板更易腐蚀
参考答案:A.明矾水解生成氢氧化铝胶体,可除去水中的悬浮物,但不能使海水淡化,故A错误;
B.氟氯代烃可破坏臭氧层,应减少使用,故B正确;
C.含磷洗涤剂会造成水体的富营养化,导致水质恶化,故C正确;
D.铁比锡活泼,易形成原电池的负极而被氧化,故D正确.
故选A.
本题解析:
本题难度:简单
3、填空题 (15分)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是 ?。
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是:?。电池工作一段时间后,电解质溶液的pH将?(填“增大”、“减小”、“不变”)。
(2)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为?,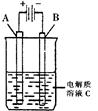
则肼-空气燃料电池理论上消耗的空气?L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因?。
(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)?0.1
mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(5)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2
mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+
离子浓度由大到小的顺序为?。
参考答案:(15分,除标注外每空2分)
(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624 kJ/mol
N2H4+ 4OH- — 4e-=4H2O +N2↑?减小(1分)
(2)? 13? 1.4
(3)N2H4+H2O  N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H2+6+OH-
N2H2+6+OH-
(4)大于
(5)c(N2H+5)>c(Cl-)>c(OH-)>c(H+)
本题解析:略
本题难度:一般
4、选择题 2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖.少年时代,他就对化学产生了浓厚的兴趣。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.将水库中的水闸(钢板)连接一块锌块,可防止水闸被腐蚀
C.由原电池原理知所有的合金都比纯金属更易被腐蚀
D.铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-===Fe3+,从而形成铁锈,但此过程铜不被腐蚀
参考答案:B
本题解析:金属腐蚀就是金属失去电子被氧化的过程,A不正确。正确,锌比铁活泼,这是牺牲阳极的阴极保护法。C是错误,有些合金是耐腐蚀的。D不正确,在电化学反应中,铁只能失去2个电子,答案选B。
本题难度:一般
5、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应是(?)
A.2H+ + 2e- ="==" H2↑
B.Fe2+ + 2e- ="=" Fe
C.2H2O + O2 + 4e- ="==" 4OH-
D.Fe3+ + e- ="==" Fe2+
参考答案:C
本题解析:原电池中负极失去电子,正极得到电子,所以钢铁发生吸氧腐蚀时,负极是铁失去电子,正极是氧气得到电子,选项C正确,答案选C。
本题难度:一般