时间:2025-06-26 00:38:12
1、计算题 (6分)氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中—份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,n(CuO)+n(Cu2O)=?。
(2)A中,n(CuO)的取值范围是?。
(3)试计算所用稀硝酸的物质的量浓度_______________。
参考答案:(1) n(Cu)+n(Cu2O)="0.300mol?" (2)0.1mol<n(CuO)<0.4mol
(3)设其中一份中n(Cu)= x mol,n(Cu2O)=" y" mol,n(CuO)=" z" mol,
依得失电子守恒和氧元素守恒,有:?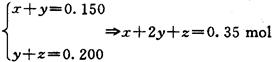
亦即反应后生成的硝酸铜的物质的量为0.350mol
则500mL稀硝酸中,n(HNO3)=0.350mol×2+0.100mol=0.800mol)
于是:c(HNO3)=0.800mol/0.500L=1.6mol/L
本题解析:略
本题难度:一般
2、选择题 在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是
A.白色沉淀是BaSO4和BaSO3
B.溶液的酸性减弱
C.白色沉淀是BaSO3
D.FeCl3全部被还原为FeCl2
参考答案:D
本题解析:由于氯化铁具有氧化性,能氧化SO2,生成硫酸和氯化亚铁,所以白色沉淀是硫酸钡,所以选项D正确,答案选D。
本题难度:一般
3、填空题 铁是一种化学性质比较活泼的金属,也是用途最为广泛的金属之一。铁在一定条件下能跟多种物质发生化学反应。完成下列问题:
(1)以铁为研究对象,仿照下图中的案例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质,生成物必须填写铁的化合物)。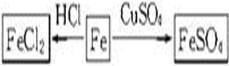
(2)实验室要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去。(只用简单的原理描述即可)
(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一。联系生活生产实际,举出防止钢铁生锈的两种常用方法:
①__________________________________________________________________。
②__________________________________________________________________。
(4)经研究发现,长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是______________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是_________________________________。
参考答案:(1)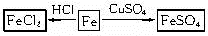
(2)化学方法:加入足量稀盐酸,铁会溶解在稀盐酸中,2HCl+Fe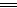 FeCl2+H2↑。物理方法:用磁铁吸引铁屑。(3)①在铁制品表面刷油漆或镀上一层其他金属 ②保持钢铁制品表面的干燥 (4)用铁锅炒菜,会有微量的铁元素进入食物中,可补充人体需要的铁元素 铁能溶解在醋中。
FeCl2+H2↑。物理方法:用磁铁吸引铁屑。(3)①在铁制品表面刷油漆或镀上一层其他金属 ②保持钢铁制品表面的干燥 (4)用铁锅炒菜,会有微量的铁元素进入食物中,可补充人体需要的铁元素 铁能溶解在醋中。
本题解析:铁是一种活泼金属,能与氧气、酸、一些盐反应。本题将铁的性质、用途及其防止铁锈的生成融合在一起,将化学与生活融合在一起,解答要从铁的性质入手,通过性质来分析其用途等。?
本题难度:一般
4、实验题 绿矾是一种重要的化工原料。
【问题1】绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质。为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)方案1:取少量溶液,加入几滴?试剂(写化学式),如果观察到的现象是溶液变血红色;实验结论:证明绿矾样品已被氧化。
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是?。实验结论:证明绿矾样品完全被氧化。
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式?。
(4)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有 (此空填序号)
A.蒸发皿
B.石棉网
C.烧杯
D.玻璃棒
【问题2】灼烧绿矾的反应方程式:2(FeSO4·7H2O)??Fe2O3+SO2↑+SO3↑+14H2O
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入下图所示的装置中。请回答以下问题: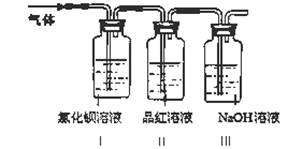
(1)装置I中氯化钡溶液中可观察到现象?。若氯化钡溶液足量,将最后所得沉淀过滤、洗涤、烘干后称重为2.33克,则灼烧绿矾的过程中转移了_________mol的电子。
(2)装置II中试剂为品红溶液,其作用是?
(3)装置III中试剂为NaOH溶液,其作用是?。
参考答案:【问题1】?(1)KSCN
(2)溶液不褪色?
(3)Fe+ 2Fe 3+=3Fe2+?
(4)蒸发浓缩;B
【问题2】?(1)有白色沉淀产生? 0.02
(2)检验产生的气体中是否含SO2,?
(3)除去多余的SO2,防止污染空气。
本题解析:【问题1】(1)绿矾中的亚铁离子被氧化成铁离子,遇KSCN变红色,因此加入KSCN溶液,若溶液变红证明被氧化
(2)酸性KMnO4可氧化亚铁离子,但不与铁离子反应,若溶液的紫色不退去,证明已完全被氧化
(3)铁与铁离子反应生成亚铁离子,离子方程式为Fe+ 2Fe3+=3Fe2+?
(4)从溶液中得到晶体的第一步是蒸发浓缩;这一系列的操作中A、蒸发皿中进行蒸发,C、烧杯中配成溶液,D、用玻璃棒进行搅拌,没有用的的是B石棉网
【问题2】(1)三氧化硫与氯化钡溶液反应生成硫酸钡白色沉淀,所以装置I中氯化钡溶液中可观察到现象是有白色沉淀产生;2.33g为硫酸钡,其物质的量为0.01mol,即三氧化硫的物质的量为0.01mol,根据绿矾分解是化学方程式可计算该过程中转移电子的物质的量为0.02mol
(2)品红溶液用来验证气体产物中是否含二氧化硫
(3)试剂为NaOH溶液用来吸收多余的二氧化硫,防止污染空气
本题难度:一般
5、选择题 在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入50mL 0.5mol·L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是?
A.N2O
B.NO
C.N2O3
D.NO2
参考答案:B
本题解析:11.4g FeSO4的物质的量为0.075mol;当反应完全后,转移的电子的物质的量为0.075mol;50mL 0.5mol·L-1KNO3的物质的量为0.025 mol;设反应后N元素的化合价为x,则有 ,得
,得 ,所以正确选项为B;
,所以正确选项为B;
本题难度:一般