时间:2025-06-26 00:37:25
1、推断题 甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、 D、E、F、G均为常见的化合物,其中A和X 的摩尔质量相同,A、F的焰色反应为黄色。在一定条件下,各物质相互转化关系如图。请回答: 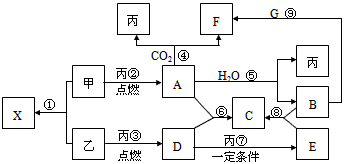
(1)写化学式:丙________ E________
(2)X的电子式为__________,G的空间构型是__________。
(3)写出反应⑤的化学反应方程式:______________________________。
(4)写出B溶液与G反应生成F的离子方程式:___________________________。
(5)在上图①-⑨的反应中,不属于氧化还原反应的是(填序号)_____________。
(6)将8g乙在足量丙中燃烧,所得气体D通入100mL 3.5mol·L-1的B溶液中,完全吸收后,溶液中的溶质及其物质的量分别为______________________;若同体积的气体D通入100mL 2.5mol·L-1的B溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为__________________________________。
参考答案:(1)O2;SO3
(2)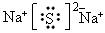 ;直线型?
;直线型?
(3)2Na2O2+2H2O==4NaOH+O2↑?
(4)CO2+2OH-==CO32-+H2O
(5)⑧⑨?
(6)0.15molNaHSO3和0.1molNa2SO3;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
本题解析:
本题难度:一般
2、填空题 (12分)化合物A是一种重要的光化学试剂。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)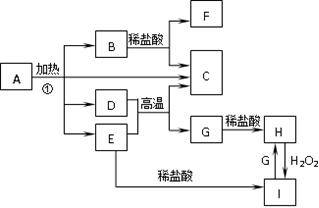
已知:化合物A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3。阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使KSCN溶液显红色。
回答下列问题:
(1)C的电子式为:?;A的化学式为:?。
(2)D+E→C+G的化学方程式:?。
(3)H+H2O2+HCl→I的离子方程式:?。
(4)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是?
_________________________________________________________________________。
参考答案:(1)?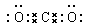 (2分)? K3Fe(C2O4)3(2分)
(2分)? K3Fe(C2O4)3(2分)
(2) 3CO + Fe2O3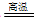 2Fe + 3CO2(2分)? (3) 2Fe2++ H2O2 + 2H+= 2Fe3++ 2H2O(2分)
2Fe + 3CO2(2分)? (3) 2Fe2++ H2O2 + 2H+= 2Fe3++ 2H2O(2分)
(4) KMnO4被C2O42-还原(2分)? Fe3+与SCN-生成了红色的Fe(SCN)3(2分)
本题解析:本题属于无机框图题。E是一种红棕色的颜料,说明E是氧化铁。因此I是氯化铁,则H是氯化亚铁,所以G是单质铁。D能把氧化铁中的铁还原生成单质铁,且D的氧化产物能使澄清石灰水变浑浊,所以D是CO2,C是CO。F的焰色反应呈紫色,所以B应该是碳酸钾。又因为A的阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍,说明阴离子是C2O42-。根据A中,三种离子的个数比为3∶1∶3,结合电荷数为0可知,A的化学式为K3Fe(C2O4)3。由于A中的阴离子具有还原性,能被酸性高锰酸钾溶液氧化,所以高锰酸钾溶液的紫色会褪去。A周期溶液中能电离出铁离子,Fe3+与SCN-生成了红色的Fe(SCN)3。
本题难度:一般
3、推断题 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系。请回答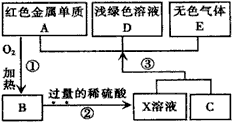
(1)反应①的基本反应类型是_____________;
(2)C的化学式为_____________;
(3)写出物质E和B在加热条件下反应的化学方程式_______________________;
(4)将浅绿色溶液D转化为黄色溶液的方法是________________________(用离子方程式表示)。
(5)乙醇在A作催化剂的条件下可以被空气中的氧气催化氧化,试写出该反应的化学方程式:
__________________________。
参考答案:(1)化合反应
(2)Fe
(3)H2+CuO Cu+H2O
Cu+H2O
(4)2Fe2++Cl2==2Fe3++2Cl-
(5)2CH3CH2OH+O2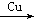 2CH3CHO+2H2O
2CH3CHO+2H2O
本题解析:
本题难度:一般
4、填空题 (14分)已知A、B为气体单质,其中A为黄绿色气体,B为无色气体;
C为化合物,其水溶液的pH小于7;D为金属单质,它们之间有下列转化关系:
(1)试写出A、B、C、D的化学式:
A_________;B_________;C___________;D_________。
(2)写出C的水溶液与D反应的离子方程式:______________________;
E溶液与A反应的离子方程式:_______________________________;
F+D反应的离子方程式:____________________________________。
参考答案:(1)( 8 分)? Cl2? H2? HCl? Fe?
(2)( 6 分)? 2H++Fe = H2↑+Fe2+?2Fe2++Cl2=2Fe3++2Cl-?2Fe3++Fe = 3Fe2+
本题解析:略
本题难度:一般
5、填空题 (14分)X、Y、Z是中学化学中常见的单质或化合物,它们能实现
如图所示的转化关系:
(1)若X是一种金属单质,X、Z分别与一种阴阳离子均为10电子物质的溶液反应都能生成Y。
①写出Y的化学式______________________,
②写出单质X与铁红反应的化学方程式________________________________________,
③写出反应I的离子方程式___________________________________________________。
(2)若Y是一种黄绿色气体,X是黑色粉末,Z是一种呈碱性的钠的化合物且能用于漂白物质。
①写出II的离子方程式______________________________________________________,
②反应I中若有0.1molX参加反应,生成Y气体的体积是____________(STP),
(3)X、Y、Z三种物质中含有同一种元素,Z为非金属单质,Y为气体,则Z为________,反应II的化学方程式为_______________________________________________________。
参考答案:(14分,每空2分)
本题解析:(1)此小题的突破口在:“②单质X与铁红反应的化学方程式”即可推知X单质为AL。于是可推知阴阳离子均为10电子物质的溶液为NaOH溶液,所以Y的化学式为NaALO2,Z这AL(OH)3;
(2)此小题的突破口在:“Y是一种黄绿色气体”即Y为CL2;X是黑色粉末即为MnO2粉末;Z为NaCLO;
(3)Z为非金属单质,在中学化学中,非金属主要学习的有:C、Si、CL、S、N等,
若为C,则Y为CO2( ),X为CO;
),X为CO;
若为CL2,则Y为HCL(CL2的实验室制备)X为NaCL(HCL的制备)
若为S,则Y为H2S,X为FeS
本题难度:简单