时间:2025-06-26 00:37:25
1、选择题 由Fe2O3、Fe、CuO、C中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)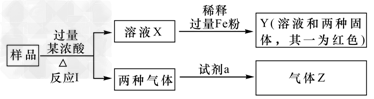
下列叙述中不正确的是
[? ]
A.若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是C+2H2SO4(浓)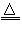 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是NO、CO2
C.向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是Cu2+、Fe2+、Fe3+、H+
D.取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2?mol?I-时,共转移3?mol电子,该反应的离子方程式是2Fe2++3H2O2+4I-===2Fe(OH)3↓+2I2
参考答案:C
本题解析:
本题难度:一般
2、选择题 X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体.下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
参考答案:D
本题解析:
本题难度:一般
3、简答题 U、V、W、X、Y、Z是原子序数依次增大的六种常见元素.Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体.
请回答下列问题:
(1)V的单质分子的结构式为?;XW的电子式为?;Z元素在周期表中的位置是?.
(2)U元素形成的同素异形体的晶体类型可能是(填序号)?.
①原子晶体?②离子晶体?③分子晶体?④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)?;V、W的氢化物分子结合H+能力较强的是(写化学式)?,用一个离子方程式加以证明:?.
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为?.
参考答案:Y的单质在W2中燃烧的产物可使品红溶液褪色.该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,根据U、V、W、X、Y、Z是原子序数依次增大可知V为N元素,
(1)V为N元素,其单质为N2,结构为N≡N,;XW为MgO,为离子化合物,电子式为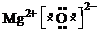
,Z为Fe元素,原子序数为26,位于元素周期表中第四周期,第VIII族,
故答案为:N≡N;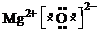
;第四周期,第VIII族.
(2)U为C元素,形成的单质有金刚石、石墨和C60等,分别属于原子晶体、混合晶体、分子晶体,故答案为:①③;
(3)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,NH3含有氢键,沸点比甲烷的沸点高,NH3的水溶液呈碱性,与水比较更易结合H+,可用NH3+H3O+=NH4++H2O的反应来证明,
故答案为:CH4;NH3;NH3+H3O+=NH4++H2O;
(4)SO2具有较强还原性,可用强氧化性物质HNO3发生氧化还原反应,生成硫酸,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+.
本题解析:
本题难度:一般
4、填空题 (10分)现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
(1)写出C2A4的电子式?。C2A4和A2D2既具有氧化性,又具有还原性,从化合价的角度解释C2A4和A2D2既具有氧化性又具有还原性的原因?
?。
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程:
? ?,该化合物与CA3和A2D的熔点由高到低的顺序为?(用化学式表示)。
?,该化合物与CA3和A2D的熔点由高到低的顺序为?(用化学式表示)。
(3)燃料电池是一种新型电池。由一种日常生活中最常见的有机物(分子式为B2A6D)与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视。写出负极的电极反应式:?。
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃。CA3、A2D、EA3的热稳定性由强到弱的顺序为?(用化学式表示)。
参考答案:(共10分)
(1)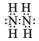 (1分)? N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性(2分)
(1分)? N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性(2分)
(2)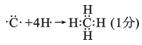 ? H2O>NH3>CH4(2分)
? H2O>NH3>CH4(2分)
(3)CH3CH2OH-12e-+16OH- 2CO32-+11H2O (2分)
2CO32-+11H2O (2分)
(4)H2O>NH3>PH3 (2分)
本题解析:略
本题难度:一般
5、填空题 (13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 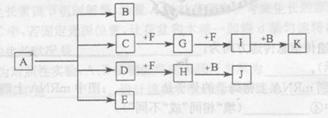
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。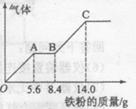
参考答案:(13分)(1)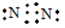 (2分) (2)红色石蕊试纸?品红溶液 (2分)
(2分) (2)红色石蕊试纸?品红溶液 (2分)
(3)3(NH4)2SO4 6H2O+4NH3↑+3SO2↑+N2↑ (3分)
6H2O+4NH3↑+3SO2↑+N2↑ (3分)
(4)SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ (3分)
(5)①9.6g (1分) ②2.24L (1分) ③2.5mol/L (1分)
本题解析:B通常情况下为无色无味液体,因此B应该是水。E、F 是空气主要成分,则二者是氮气和氧气。D能产生酸雨,所以D是SO2。SO2能和F反应生成H,则F是氧气,E是氮气,H是三氧化硫。三氧化硫和水反应生成J,J是硫酸。I为红棕色气体,则I是NO2。G和氧气反应生成NO2,所以G是NO。NO2溶于水生成硝酸和NO。K是酸,则K是硝酸。C和氧气反应生成NO,且C与J反应可得A,所以C是氨气,A就是硫酸铵。
(1)氮气是含有非极性键的单质,其电子式是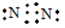 。
。
(2)氨气是碱性气体,可用红色石蕊试纸检验;SO2具有漂白性,可用品红溶液检验。
(3)A强热分解生成B、C、D、E的化学方程式3(NH4)2SO4 6H2O+4NH3↑+3SO2↑+N2↑。
6H2O+4NH3↑+3SO2↑+N2↑。
(4)SO2具有还原性,能被铁离子氧化,因此该反应的离子方程式是SO2+2Fe3++2H2O=SO42-+2Fe2++4H+。
(5)硝酸是氧化性酸,所以根据图像可知,O→A发生的反应是Fe+4H++NO3-=Fe3++NO↑+2H2O。A→B发生反应的方程式是2Fe3++Fe=3Fe2+;B→C发生反应的方程式是Fe+2H+=Fe2++H2↑。三阶段中消耗铁的物质的量分别是5.6g÷56g/mol=0.1mol、(8.4g-5.6g)÷56g/mol=0.05mol、(14.0g-8.4g)÷56g/mol=0.1mol,所以根据氮元素守恒可知,硝酸的物质的量是0.1mol。最终溶液中只有硫酸亚铁,则根据原子守恒可知,硫酸亚铁的物质的量是0.25mol,因此硫酸的物质的量也是0.25mol,则硫酸的浓度是0.25mol÷0.1L=2.5mol/L。另一份溶液中,氢离子和NO3-的物质的量分别是0.6mol和0.1mol,则根据方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子过量,所以NO3-完全被还原生成NO,则NO的物质的量是0.1mol,在标准状况下的体积是2.24L。其中溶解铜的质量是0.15mol×64g/mol=9.6g。
本题难度:困难