时间:2025-06-26 00:31:42
1、填空题 下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题
| ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ① | ? | ② | ? | ? |
| ③ | ? | ? | ? | ? | ? | ? | ? | ? | ? | ④ | ? | ? | ⑤ | ⑥ | ? |
2、选择题 下列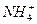 与NH3所含的质子数、核外电子数的关系描述正确的是(?)
与NH3所含的质子数、核外电子数的关系描述正确的是(?)
A.质子数前者大于后者,核外电子数二者均相等
B.质子数、核外电子数均相等
C.质子数前者与后者相等,核外电子数前者小于后者
D.质子数前者大于后者,核外电子数前者大于后者
3、选择题 我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
A.10Be和9Be是中子数不同质子数相同的不同原子
B.10Be的原子核内中子数比质子数多
C.5.2 g26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数、中子数和核外电子数都不相同
4、选择题 几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | –1 | –2 | +4、–4 | –1 | +5、–3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
5、选择题 我国嫦娥工程探月计划的一个重要目标是开发月球新能源3He,10t的3He就能满足一年的能源需求,下列关于3He的说法正确的是
A.质子数为3,电子数为3
B.质子数为2,电子数为3
C.质子数为2,中子数为3
D.核素3He与核素4He都是He元素的同位素