时间:2025-06-26 00:31:42
1、填空题 下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
参考答案:(11分)(1)第三周期第VIIA族(2分) ?(2)HClO4?(2分)
(3) ?(2分)?(4)Al(OH)3 + 3H+= Al3+ + 3H2O?(2分) (5)A、B、D?(3分)
?(2分)?(4)Al(OH)3 + 3H+= Al3+ + 3H2O?(2分) (5)A、B、D?(3分)
本题解析:根据元素原子半径和主要化合价可知,①~⑧元素分别是Na、Mg、Li、Al、P、Cl、N、O。
(1)氯元素在元素周期表中的位置是第三周期第VIIA族。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,则在这8种元素的最高价氧化物的水化物中,酸性最强的是HClO4。
(3)①⑥形成物质是氯化钠,含有离子键的离子化合物,其电子式为 。
。
(4)④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式Al(OH)3 + 3H+= Al3+ + 3H2O。
(5)⑥在同主族元素中非金属性不是最强的,最强的是F,C不正确;①与⑧形成的化合物是氧化钠或过氧化钠,不具有两性,E不正确,其余选项都是正确的,答案选ABD。
点评:该题是高考中的常见考点,属于基础性试题的考查。侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
本题难度:一般
2、选择题 金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关48Ti和50Ti的说法正确的是(?)
A.48Ti和50Ti的质子数相同,互称同位素
B.48Ti和50Ti的质量数不同,属于两种元素
C.48Ti和50Ti的质子数相同,是同一种核素
D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体
参考答案:A
本题解析:48Ti和50Ti为两种不同的核素,且它们的质子数相同,但中子数不同,所以互为同位素,答案选A。
本题难度:一般
3、填空题 A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A形成的单质密度最小(相同条件下)。B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)元素C位于元素周期表的?周期?族,原子结构示意图为?。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是?(填化学式),BE4分子的空间构型是?。
(3)元素A与B形成原子个数比为1:1的相对分子质量最小的化合物的结构式为?。
(4)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒之间反应的其中一个化学方程式或离子方程式:?
(5)写出E的单质制取漂白粉反应的化学方程式并标出电子转移的方向和数目:?
参考答案:(共16分)
(1)二? VA?(2分) (2分),
(2分),
(2)H2O>NH3>CH4(2分)?正四面体(2分)
(3)  ?(2分)
?(2分)
(4)NH3+H2O=NH3·H2O或OH-十NH4+=NH3·H2O(2分)
(5) (化学方程式2分,电子转移2分,共4分)
(化学方程式2分,电子转移2分,共4分)
本题解析:根据题意可以推断A、B、C、D、E分别为H、C、N、O、Cl。10个电子的离子可以以氖为中心,氖前面的阴离子和氖后面的阳离子以及阴离子对应的氢化物、氢化物的阴阳离子等。H、C、N、O想到CH4、NH3(NH2-、NH4+)、H2O(H3O+、OH-)、HF等。Cl2与漂白粉的反应为歧化反应,在表电子转移是最好使用单线桥法(参考答案以及2012安徽高考卷均使用双线桥法,不知何意)
本题难度:一般
4、选择题  Cl、
Cl、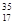 Cl为不同的核素,下列说法正确的是
Cl为不同的核素,下列说法正确的是
A. Cl2的摩尔质量是74
Cl2的摩尔质量是74
B.通常情况下,氯气做氧化剂,但氯气也具有还原性
C. Cl、
Cl、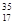 Cl互为同位素,
Cl互为同位素,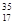 Cl2与
Cl2与 Cl2互为同素异形体
Cl2互为同素异形体
D.常温下,4.48L Cl2含有8NA个中子(NA为阿伏加德罗常数的值)
Cl2含有8NA个中子(NA为阿伏加德罗常数的值)
参考答案:B
本题解析:摩尔质量的单位是mol?L?1,A项错;Cl2中Cl元素的化合价为0,可以降低为-1价,也可以升高为正价,B项正确;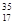 Cl2与
Cl2与 Cl2不是同素异形体,C项错;标准状况的温度是0℃,所以常温下4.48LCl2不是0.02mol,D项错。
Cl2不是同素异形体,C项错;标准状况的温度是0℃,所以常温下4.48LCl2不是0.02mol,D项错。
本题难度:一般
5、选择题 2011年3月,日本福岛核电站由于地震损毁而造成放射性物质泄漏,在我国多地检测出极微量的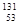 I,关于
I,关于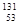 I的下列说法中正确的是(?)
I的下列说法中正确的是(?)
A.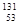 I是放射性核素,应该多吃加碘食盐来预防其对人体的损害
I是放射性核素,应该多吃加碘食盐来预防其对人体的损害
B.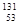 I与
I与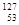 I属于碘元素的两种不同核素,互称同素异形体
I属于碘元素的两种不同核素,互称同素异形体
C.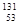 I与
I与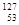 I属于同种元素,所以性质完全相同
I属于同种元素,所以性质完全相同
D.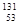 I核内中子数比核外电子数多25个
I核内中子数比核外电子数多25个
参考答案:D
本题解析:在表示原子的组成时元素符号的左下角表示质子数,左上角表示质量数,因此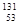 I的质子数是53,质量数是131,则中子数是131-53=78,所以中子数比核外电子数多78-53=25,选项D是正确的。同素异形体是指同种元素组成的不同单质,B错误。
I的质子数是53,质量数是131,则中子数是131-53=78,所以中子数比核外电子数多78-53=25,选项D是正确的。同素异形体是指同种元素组成的不同单质,B错误。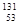 I与
I与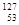 I的质量数不同,属于不同的核素,C不正确。食盐加碘是原来预防甲状腺肿大的,A不正确。答案是D。
I的质量数不同,属于不同的核素,C不正确。食盐加碘是原来预防甲状腺肿大的,A不正确。答案是D。
本题难度:一般