时间:2025-06-26 00:27:37
1、填空题 A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。
根据以上信息回答下列问题:
(1)B元素在周期表中的位置是____________,乙物质的电子式是____________
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是____________(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是____________________________
参考答案:
(1)第二周期,VIA族;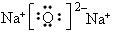
(2)O<N<Al<Mg<Na
(3)2Al+2OH-+2H2O==2AlO2-+3H2↑
本题解析:
本题难度:一般
2、推断题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。C元素原子核外最外层电子数是其次外层电子数的3倍,D原子比C原子多一个电子层,化合物DC的晶体为离子晶体。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。
请根据以上情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_______________________;DC晶体中结构微粒半径大小比较为__________________;
(2)B的氢化物的分子空间构型是__________________;其中心原子采取__________杂化。
(3)B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高的原因是__________________。
(4)化合物AC2的电子式为__________________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为__________________。
(5)E元素原子的核外电子排布式为____________;ECl3与B、C的氢化物形成的六配位配合物的化学式为__________________。
参考答案:(1)C<O<N;Mg2+<O2-
(2)三角锥形;sp3
(3)NH3分子之间、H2O分子之间都可以形成较强的氢键
(4) ;N2O?
;N2O?
(5)1s22s22p63s23p63d54s1;[Cr(NH3)4(H2O)2]Cl3
本题解析:
本题难度:一般
3、填空题 按构造原理写出35号元素的基态原子的电子排布式:___________,其价电子层为___________,其所在主族的价电子层为:___________,最高化合价为:___________,最低化合价为:___________。
参考答案:“略”
本题解析:
本题难度:一般
4、选择题 下列各组元素各项性质比较正确的是
A.第一电离能:B
C.电负性:O>C>Si>Na
D.半径:Na + > Cl-
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列叙述中正确的是
[? ]
参考答案:C
本题解析:
本题难度:简单