时间:2025-06-26 00:26:47
1、选择题 对于某容器中一定条件下进行的反应N2+3 H2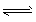 2NH3,能增大化学反应速率的措施是?
2NH3,能增大化学反应速率的措施是?
[? ]
参考答案:B
本题解析:
本题难度:一般
2、填空题 (14分)向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t?4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=?。
(2)t4-t5阶段改变的条件为?,B的起始物质的量为?。
该反应方程式可表示为?
各阶段平衡时对应的平衡常数如下表所示:
| t1—t2 | t2—t3 | t3—t4 | t4—t5 | t5—t6 |
| K1 | K?2 | K3 | K4 | K5 |
参考答案:
(1)? 0.02 mol/(L.min)?
(2)?减压(或扩大容器体积)?1mol?2A+B 3C?
3C?
0.84?=? =? = ?<?
(3) ?a:b="2:1" ?c ≥0
本题解析:1、根据反应速率的计算公式即可计算出v(C)="0.02" mol/(L.min),注意单位不能省。
2、根据图表可以初步分析出A为反应物C为生成物,再根据t4-t5阶段改变的条件,速率都减小,而平衡未移动,说明不是降温,也不是改变了浓度,所以只能是降压,或者体积减小,可以推断出该反应为气体体积不变的反应,由此可以推算出反应式为? 2A+B 3C ,首先根据C的起始浓度与物质的量计算出容器体积为2L,所以A反应掉了0.2*2=0.4mol,B反应了0.2mol,最后B剩余0.4*2=0.8mol,所以起始物质的量为1mol。
3C ,首先根据C的起始浓度与物质的量计算出容器体积为2L,所以A反应掉了0.2*2=0.4mol,B反应了0.2mol,最后B剩余0.4*2=0.8mol,所以起始物质的量为1mol。
根据平衡常数=生成物的浓度的序数次幂/反应物的浓度的序数次幂,根据图表可以计算出各个阶段的反应平衡常数,又因为反应的平衡常数只与温度有关,当反应的温度保持不变时,反应的平衡常数保持不变。最后一个阶段,升温,使平衡正移,所以平衡常数最大。
3、根据反应前后体积不变的反应,要达到等效平衡只需要反应物的浓度之比等于原始浓度之比即可,所以要达到等效平衡只要a:b="2:1" ?c ≥0?
点评:本题难度适中,主要考察了化学平衡的判断及计算,理解平衡常数只与温度有关及等效平衡的条件是解题的关键,另外还需要仔细看图,看清图像的横纵坐标,不要忽略图像信息。
本题难度:一般
3、选择题 下列做法,不能使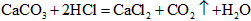 的反应速率增大的是
的反应速率增大的是
[? ]
A.增大盐酸的浓度
B.碾碎碳酸钙
C.适当加热
D.把2mol/L盐酸换成2mol/LH2SO4
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法不正确的是( )
A.反应物的分子的每次碰撞都能发生化学反应
B.反应物分子(或离子)间的每次碰撞是反应的先决条件
C.参加反应的物质的性质是决定化学反应速率的重要因素
D.活化分子具有比普通分子更高的能量
参考答案:A、反应物分子的每次碰撞不一定能发生化学反应,只有活化分子的有效碰撞才能发生化学反应,故A错误;
B、反应物分子间的每次碰撞是反应的先决条件,活化分子的有效碰撞是发生化学反应的充要条件,故B正确;
C、参加反应的物质的性质是决定化学反应速率的重要因素,温度、压强等影响化学反应速率的因素是次要因素,故C正确;
D、能够发生有效碰撞的分子是活化分子,活化分子具有比普通分子更高的能量,故D正确;
故选A.
本题解析:
本题难度:简单
5、选择题 (12分)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
A.减压
B.增加NH3的浓度
C.升温
D.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
参考答案:(1) B、C;(2)2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;
(3)C>N>O>H;NH3和PH3的稳定性或最高价含氧酸的酸性。
(4)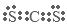 ,CS2和CO2都是分子晶体,相对分子质量CS2大,分子间作用力就大。
,CS2和CO2都是分子晶体,相对分子质量CS2大,分子间作用力就大。
本题解析:(1) A.减压,物质的浓度减小,化学反应速率减小,错误; B.增加NH3的浓度,化学反应速率加快,正确; C.升温,化学反应速率加快,正确; D.及时移走产物,物质的浓度减小,化学反应速率减小,错误;(2)铜液中的氨可吸收二氧化碳,该反应的化学方程式是2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;(3)铜液的组成元素中,含有的短周期元素有H、C、N 、O;在这些元素中,同一周期的元素,原子序数越大,原子半径就越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。所以短周期元素原子半径从大到小的排列顺序为C>N>O>H;元素的非金属性越强,其相应的氢化物的稳定性就越强,对应的最高价氧化物的水化物的酸性就越强。所以可以通过比较NH3和PH3的稳定性或HNO3、H3PO4的酸性判断元素的非金属性的强弱。(4)CS2与CO2分子结构相似,都是直线型分子,原子间通过形成四对共用电子对结合,电子式是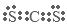 ,在固态时CS2和CO2都是分子晶体,结构相似,大于结构相似的物质来说,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高,物质的熔沸点就越高。由于相对分子质量CS2大,所以分子间作用力CS2就大,因此。熔点CS2>CO2。
,在固态时CS2和CO2都是分子晶体,结构相似,大于结构相似的物质来说,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高,物质的熔沸点就越高。由于相对分子质量CS2大,所以分子间作用力CS2就大,因此。熔点CS2>CO2。
考点:考查影响化学反应速率的因素、物质的化学性质的方程式表示、原子半径的大小比较、元素的非金属性强弱比较的方法、
本题难度:一般