时间:2025-06-26 00:25:09
1、实验题 一包白色粉末中一定含有碳酸钠,可能还含有硫酸钠、氯化钠中的一种或两种,为进一步确认白色粉末的成份,某兴趣小组对白色粉末样品进行了探究。
可选用的仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹
可选用的药品:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2、0.1 mol·L-1Ba(NO3)2、蒸馏水。
(1)以下是实验探究过程:
1)提出假设:
假设1 白色粉末为___________的混合物;
假设2 白色粉末为___________的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(2)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是___________(填“对的”或“错的”),原因是:______________________。
(3)基于假设3,请根据实验方案,将实验操作和预期的现象及结论填入下表中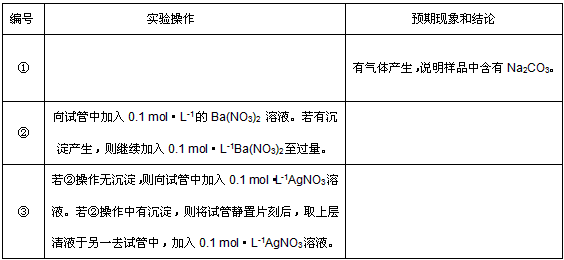
参考答案:(1)假设1 :碳酸钠、氯化钠;假设2:碳酸钠、硫酸钠
(2)错的;溶液中含有CO32-,可与BaCl2溶液产生BaCO3沉淀,因此无法确定该沉淀是BaSO4(3)
本题解析:
本题难度:困难
2、选择题 下列结论正确的是?(?)
参考答案:D
本题解析:略
本题难度:一般
3、实验题 已知2NO2(g)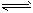 N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题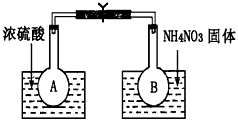
(1)观察到的实验现象为:_____________________________
(2)由实验现象可知,升高温度,该化学平衡向___________(填“正”或“逆”)反应方向移动,反应中NO2的转化率将_______________(填“增大”、“减小”或“不变”)。
Ⅱ. 在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(3)某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:________________________。
(4)某同学将第三支针筒活塞迅速拉至20mL处。
① 该同学观察到的现象是:__________________________
② 在此过程中,该反应的化学平衡常数将______________(填“增大”、“减小”或“不变”)。
参考答案:(1)A瓶中气体颜色加深,B瓶中气体颜色变浅
(2)逆;减小
(3)增大压强,平衡向正反应方向移动,NO2浓度减小
(4)①气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅;②不变
本题解析:
本题难度:一般
4、简答题 水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等.请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2.(加热装置和导管等在图中略去)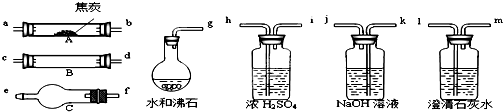
回答下列问题:
(1)盛浓H2SO4的装置用途是______,盛NaOH溶液的装置用途是______.
(2)仪器B中需加入试剂的名称(或化学式)是:______,所发生反应的化学方程式是:______.
(3)仪器C中需加入试剂的名称(或化学式)是:______,其目的是______.
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:______.
(5)能证明混合气中含有CO的实验依据是______.
(6)能证明混合气中含有H2的实验依据是______.
参考答案:(1)浓硫酸可以做干燥剂,盛浓H2SO4的装置用途是将气体干燥,除去水蒸气,检验一氧化碳还原氧化铜的产物二氧化碳之前要先将生成的二氧化碳除去,可以用氢氧化钠来吸收,
故答案为:除去水蒸气;除去CO2;
(2)检验合气体中有CO和H2可用氧化铜,发生反应:CuO+H2?△?.?Cu+H2O、CuO+CO?△?.?Cu+CO2,氢气和一氧化碳还原氧化铜是在大试管中进行的,故答案为:氧化铜(CuO);CuO+H2?△?.?Cu+H2O、CuO+CO?△?.?Cu+CO2;
(3)检验水可用无水硫酸铜,将其装入干燥管中进行检验,
故答案为:无水硫酸铜(CuSO4);检验H2O;?
(4)为了验证混合气中含有CO和H2,实验仪器的连接先后顺序为:除二氧化碳→除掉水分→还原装置→检验水分→检验二氧化碳;除杂质连接仪器的原则是:长进短出;故答案为:g-ab-kj-hi-cd(或dc)-fe-lm;
(5)如果有CO存在,CO和黑色的氧化铜反应生成红色的铜和二氧化碳,原混合气中的CO2已被除去,其中CO与CuO反应生成的CO2使澄清石灰水变浑浊,故答案为:B中黑色的CuO变成红色粉末,最后装置的澄清石灰水变浑浊;
(6)如果有氢气存在,氢气和黑色的氧化铜反应生成红色的铜和水,水和白色的无水硫酸铜反应生成蓝色的硫酸铜晶体,故答案为:B中黑色的CuO变成红色粉末,C中无水硫酸铜由白色变为蓝色.
本题解析:
本题难度:一般
5、选择题 下列有关实验操作或仪器的使用正确的是?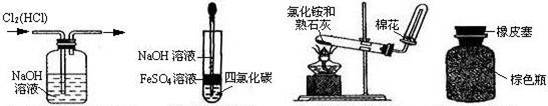
A? B? C? D
A.除去氯气中的氯化氢
B.制备Fe(OH)2
C.实验室制备氨气
D.保存浓硝酸
参考答案:C
本题解析:A、氯气和氯化氢均与氢氧化钠反应,错误;B、四氯化碳密度大于水,不能在水面隔离空气,错误;C、正确;D、浓硝酸具有强氧化性,不能用橡皮塞,见光易分解,应放棕色瓶避光保存,错误。
本题难度:简单