时间:2025-06-26 00:25:09
1、实验题 一包白色粉末中一定含有碳酸钠,可能还含有硫酸钠、氯化钠中的一种或两种,为进一步确认白色粉末的成份,某兴趣小组对白色粉末样品进行了探究。
可选用的仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹
可选用的药品:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2、0.1 mol·L-1Ba(NO3)2、蒸馏水。
(1)以下是实验探究过程:
1)提出假设:
假设1 白色粉末为___________的混合物;
假设2 白色粉末为___________的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(2)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是___________(填“对的”或“错的”),原因是:______________________。
(3)基于假设3,请根据实验方案,将实验操作和预期的现象及结论填入下表中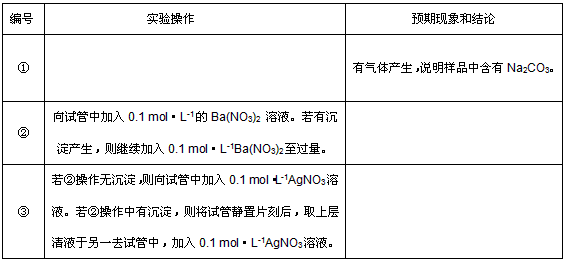
2、选择题 下列结论正确的是?(?)
3、实验题 已知2NO2(g)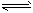 N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题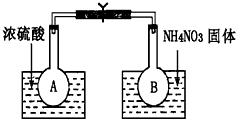
(1)观察到的实验现象为:_____________________________
(2)由实验现象可知,升高温度,该化学平衡向___________(填“正”或“逆”)反应方向移动,反应中NO2的转化率将_______________(填“增大”、“减小”或“不变”)。
Ⅱ. 在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(3)某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:________________________。
(4)某同学将第三支针筒活塞迅速拉至20mL处。
① 该同学观察到的现象是:__________________________
② 在此过程中,该反应的化学平衡常数将______________(填“增大”、“减小”或“不变”)。
4、简答题 水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等.请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2.(加热装置和导管等在图中略去)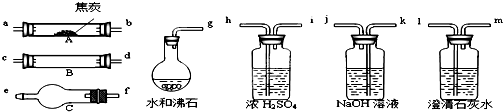
回答下列问题:
(1)盛浓H2SO4的装置用途是______,盛NaOH溶液的装置用途是______.
(2)仪器B中需加入试剂的名称(或化学式)是:______,所发生反应的化学方程式是:______.
(3)仪器C中需加入试剂的名称(或化学式)是:______,其目的是______.
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:______.
(5)能证明混合气中含有CO的实验依据是______.
(6)能证明混合气中含有H2的实验依据是______.
5、选择题 下列有关实验操作或仪器的使用正确的是?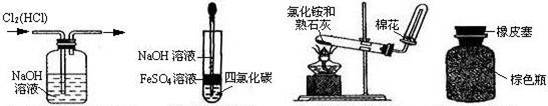
A? B? C? D
A.除去氯气中的氯化氢
B.制备Fe(OH)2
C.实验室制备氨气
D.保存浓硝酸