时间:2025-06-26 00:21:02
1、选择题 为了治理废水中Cr2O72-的污染,常先加入试剂使之变为Cr3+,该试剂为
A.NaOH溶液
B.FeCl3溶液
C.明矾
D.Na2SO3和H2SO4
参考答案:D
本题解析:从重铬酸根到三价铬离子,被还原,需要加入还原剂。故只有D符合。
本题难度:一般
2、选择题 某元素的原子结构示意图为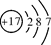 ,下列关于该原子的说法正确的是
,下列关于该原子的说法正确的是
A.质子数为7
B.核电荷数为34
C.核外电子数为7
D.核外有3个电子层
参考答案:D
本题解析:原子结构示意图是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数,据此可知D正确,答案选D。
点评:该题是基础性试题的考查,也是高考中的常见题型。试题基础性强,侧重对学生基础知识对训练和检验。该题的关键是明确原子结构示意图的表示方法。
本题难度:简单
3、选择题 下列物质溶于水,不发生氧化还原反应的是
A.NO2溶于水
B.Na2O2溶于水
C.Cl2溶于水
D.CaO溶于水
参考答案:D
本题解析:A.NO2溶于水3NO2+ H2O = 2HNO3+ NO,有元素化合价的升降,是氧化还原反应。错误。B.Na2O2溶于水2Na2O2+2H2O="4NaOH+" O2↑。有元素化合价的升降,是氧化还原反应。错误。C.Cl2溶于水Cl2+H2O HCl+HClO,元素的化合价发生了变化,是氧化还原反应。错误。D.CaO溶于水CaO+H2O= Ca(OH)2.元素的化合价未发生变化,不是氧化还原反应。正确。
HCl+HClO,元素的化合价发生了变化,是氧化还原反应。错误。D.CaO溶于水CaO+H2O= Ca(OH)2.元素的化合价未发生变化,不是氧化还原反应。正确。
本题难度:一般
4、选择题 ClO2遇浓盐酸会生成Cl2,反应方程式为2ClO2+8HCl====5Cl2+4H2O,该反应中若转移电子的数目为9.632×1023,则产生的Cl2在标准状况下的体积为 ( )
A.11.2 L
B.33.6 L
C.22.4 L
D.44.8 L
参考答案:C
本题解析: n(e-)=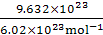 =1.6 mol。因为2ClO2~Cl2~8e-,8HCl~4Cl2~8e-,所以该反应转移的电子数为8e-,即5Cl2~8e-,所以n(Cl2)=
=1.6 mol。因为2ClO2~Cl2~8e-,8HCl~4Cl2~8e-,所以该反应转移的电子数为8e-,即5Cl2~8e-,所以n(Cl2)= n(e-)=
n(e-)= ×1.6 mol="1" mol,V(Cl2)="1" mol×22.4 L·mol-1=22.4 L。
×1.6 mol="1" mol,V(Cl2)="1" mol×22.4 L·mol-1=22.4 L。
考点:氧化还原反应
本题难度:一般
5、选择题 分析如下残缺的反应:RO3-+?+6H+=3R2+3H2O。下列叙述正确的是
A.元素R位于周期表中第ⅤA族
B.RO中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO参与该反应,则转移的电子的物质的量为5 mol
参考答案:D
本题解析:略
本题难度:一般